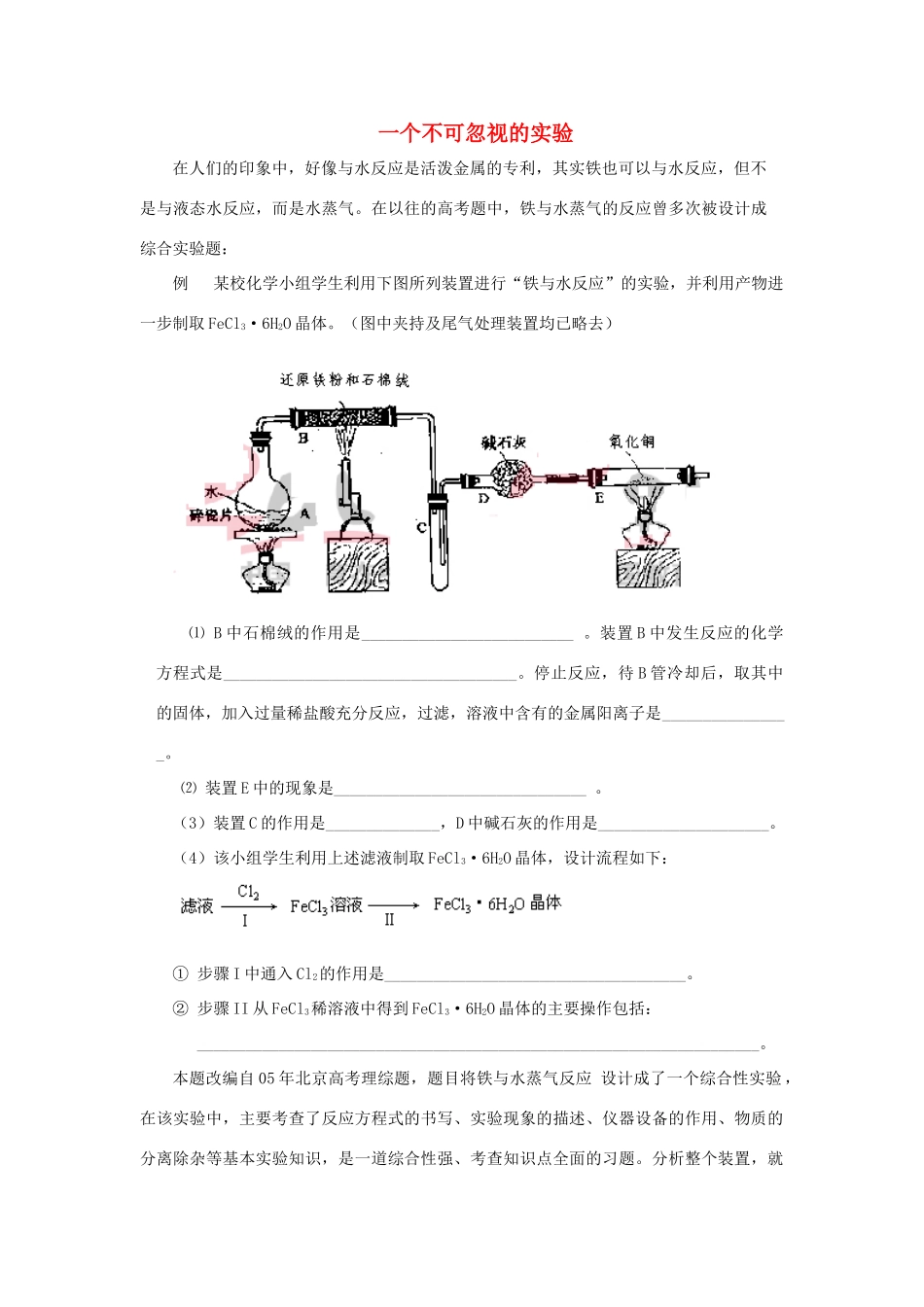
一个不可忽视的实验在人们的印象中,好像与水反应是活泼金属的专利,其实铁也可以与水反应,但不是与液态水反应,而是水蒸气。在以往的高考题中,铁与水蒸气的反应曾多次被设计成综合实验题:例 某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取 FeCl3·6H2O 晶体。(图中夹持及尾气处理装置均已略去)⑴ B 中石棉绒的作用是__________________________ 。装置 B 中发生反应的化学方程式是____________________________________。停止反应,待 B 管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤,溶液中含有的金属阳离子是________________。⑵ 装置 E 中的现象是_______________________________ 。(3)装置 C 的作用是______________,D 中碱石灰的作用是_____________________。(4)该小组学生利用上述滤液制取 FeCl3·6H2O 晶体,设计流程如下:① 步骤 I 中通入 Cl2的作用是_____________________________________。② 步骤 II 从 FeCl3稀溶液中得到 FeCl3·6H2O 晶体的主要操作包括: _____________________________________________________________________。本题改编自 05 年北京高考理综题,题目将铁与水蒸气反应 设计成了一个综合性实验 ,在该实验中,主要考查了反应方程式的书写、实验现象的描述、仪器设备的作用、物质的分离除杂等基本实验知识,是一道综合性强、考查知识点全面的习题。分析整个装置,就会发现,A 装置的作用主要是产生水蒸气,由于实验中使用的是铁粉,在强大的气流作用下,铁粉会被吹向右侧的导气管中,这样会阻塞导管,因此用石棉绒将铁粉固定,同时也增大了铁粉与水蒸气接触的面积;B 装置中铁与水蒸气反应,生成四氧化三铁和氢气,将固体产物溶于盐酸,会生成 Fe2+和 Fe3+,在滤液中通入氯气,目的是将 Fe2+氧化,最后通过加热浓缩、冷却结晶、过滤的方法得到 FeCl3·6H2O 晶体。在试管 C 中,大量的水蒸气被冷却,少量的水蒸气被 D 中的碱石灰吸收,干燥后的氢气在 E 中还原氧化铜,生成铜和水,此时可观察到黑色的氧化铜变红,右端管壁有水珠凝结。答案:(1)固定铁粉,防止粉末阻塞导管,增大铁粉与水蒸气的接触面积3Fe + 4H2O Fe3O4 + 4H2↑ Fe2+和 Fe3+⑵ 黑色固体变红,右端管壁有水珠(3)冷凝水蒸气 干燥氢气(或除去氢气中的水蒸气)⑶ 取少量滤液,滴入几滴 KSCN 溶液,观察溶液是否变红色⑷ ① 将 Fe2+氧化成 Fe3+② 加热浓缩、冷却结晶、过滤