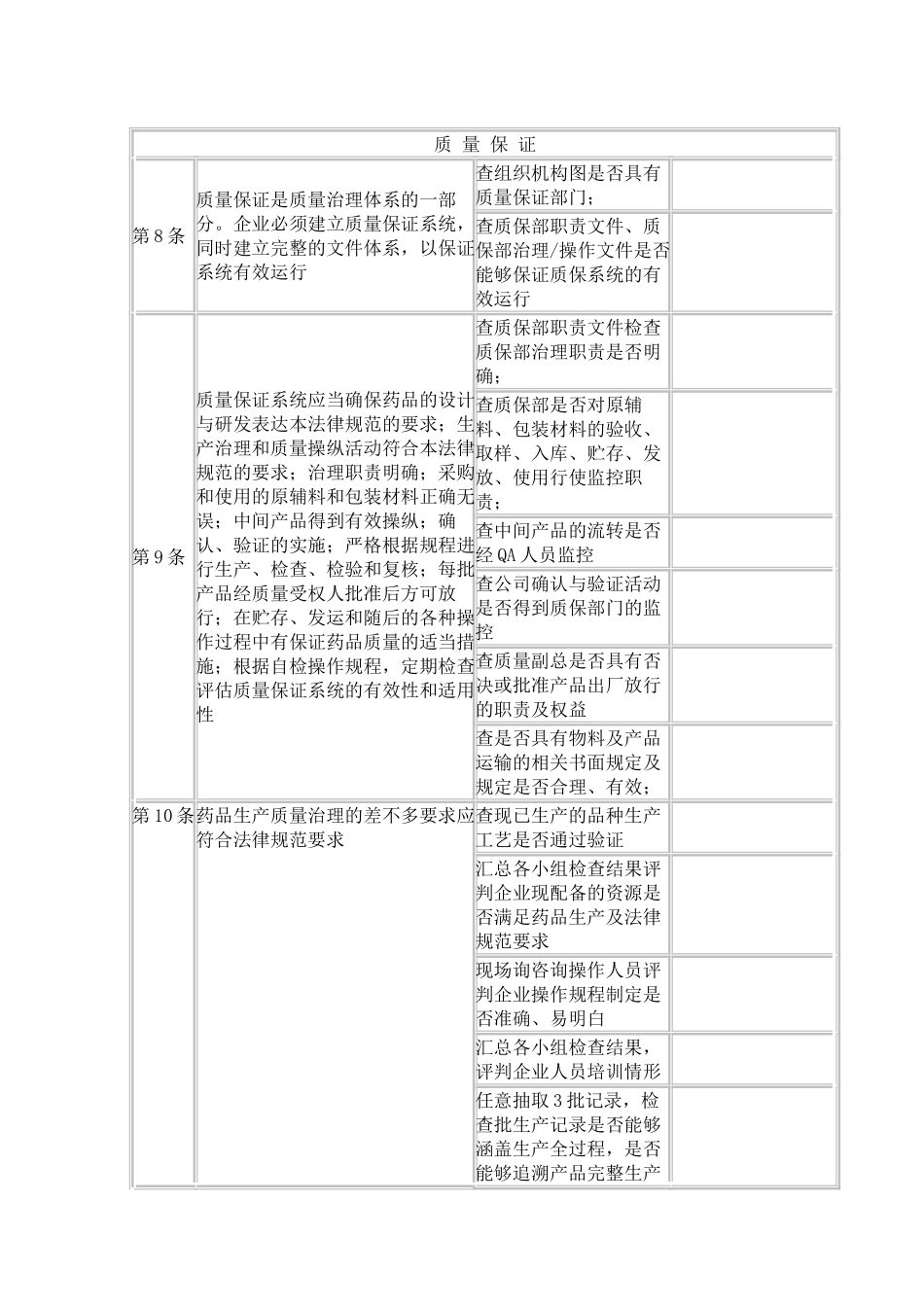
GMP 自检记录 条款检查内容检查方法检查结果原 则第 5 条企业应当建立符合药品质量治理要求的质量目标,将药品注册的有关安全、有效和质量可控的所有要求,系统地贯彻到药品生产、操纵及产品放行、贮存、发运的全过程中,确保所生产的药品符合预定用途和注册要求查企业是否具有质量目标书面文件 查企业目标文件是否涵盖法律规范所有相关要求内容 第 6 条企业高层治理人员应当确保实现既定的质量目标,不同层次的人员以及供应商、经销商应当共同参加并承担各自的责任对比组织机构图查企业高层治理人员职责文件是否齐全 查企业高层治理人员职责文件是否规定高层人员质量职责与目标; 查各级人员及供应商、经销商是否规定其质量职责 第 7 条企业应当配备足够的、符合要求的人员、厂房、设施和设备,为实现质量目标提供必要的条件。查是否依照组织机构配备相应的技术、治理人员 依照各部门人员定编、定岗情形,查企业各部门人员配置是否能够保证质量目标的实现 12RD11001012025 版药品 GMP 自检内容 2025 版药品 GMP 自检内容自检范畴:机构与人员、厂房与设施、设备、物料与产品、确认与验证、文件、生产治理、质量治理、托付生产与托付检验、发放与召回、投诉与不良反应、自检自检依据:《药品生产质量治理法律规范》(2025 版)自检小组:组 长:副组长:组 员:自检日期: 月 日 至 月 日质 量 保 证第 8 条质量保证是质量治理体系的一部分。企业必须建立质量保证系统,同时建立完整的文件体系,以保证系统有效运行查组织机构图是否具有质量保证部门; 查质保部职责文件、质保部治理/操作文件是否能够保证质保系统的有效运行 第 9 条质量保证系统应当确保药品的设计与研发表达本法律规范的要求;生产治理和质量操纵活动符合本法律规范的要求;治理职责明确;采购和使用的原辅料和包装材料正确无误;中间产品得到有效操纵;确认、验证的实施;严格根据规程进行生产、检查、检验和复核;每批产品经质量受权人批准后方可放行;在贮存、发运和随后的各种操作过程中有保证药品质量的适当措施;根据自检操作规程,定期检查评估质量保证系统的有效性和适用性查质保部职责文件检查质保部治理职责是否明确; 查质保部是否对原辅料、包装材料的验收、取样、入库、贮存、发放、使用行使监控职责; 查中间产品的流转是否经 QA 人员监控 查公司确认与验证活动是否得到质保部门的监控 查质量副总是否具有否决或批...