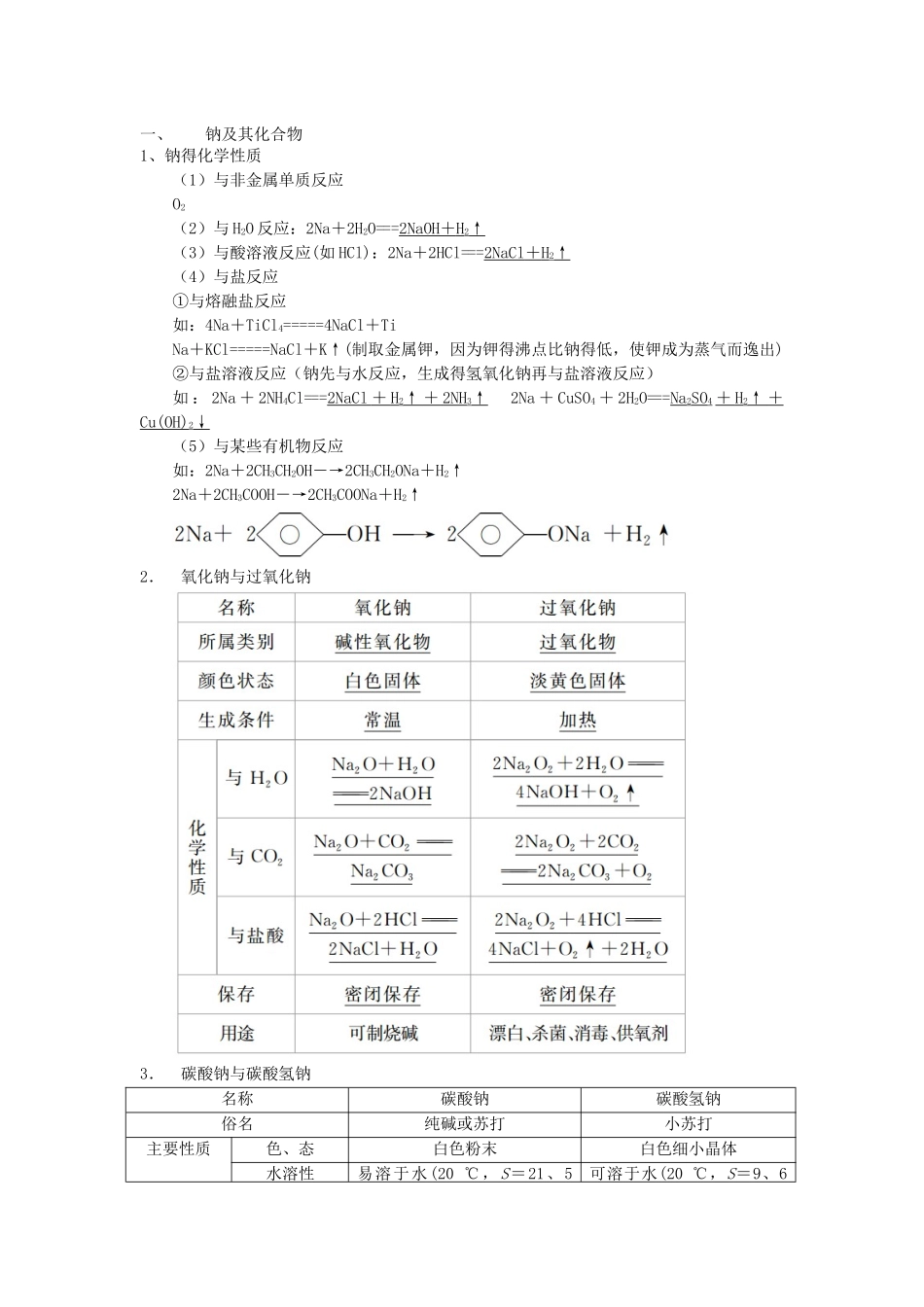
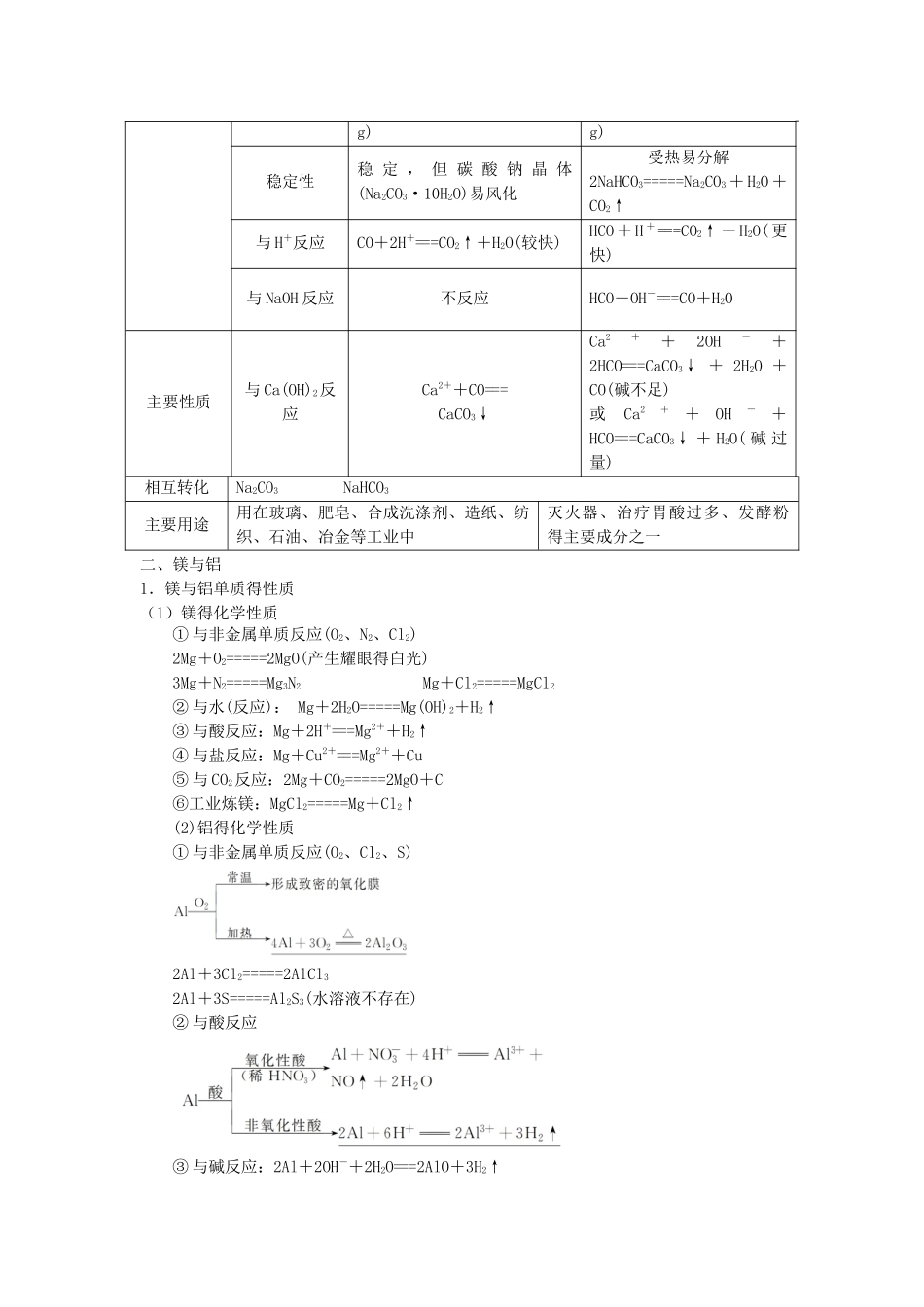
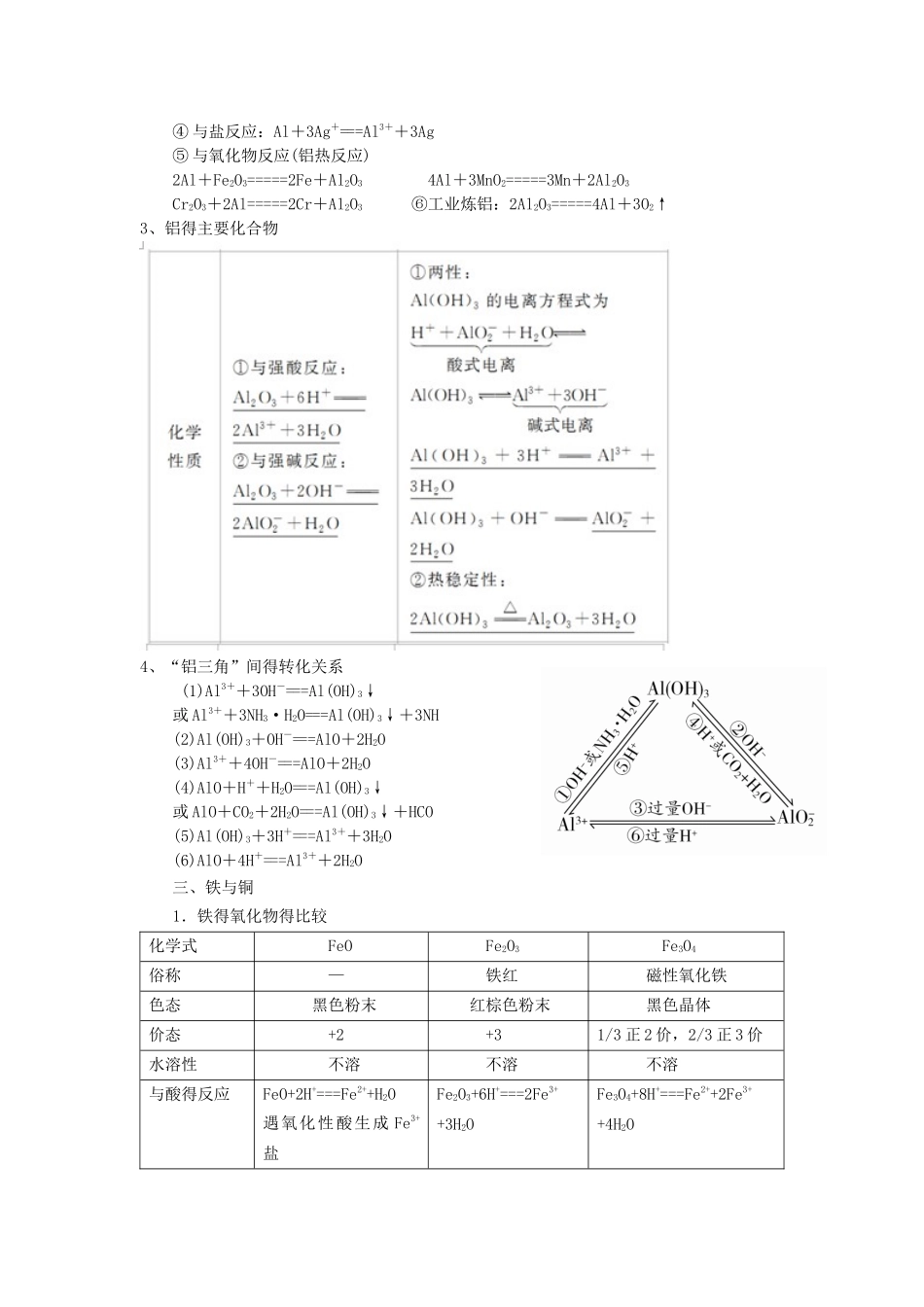
一、钠及其化合物1、钠得化学性质(1)与非金属单质反应O2(2)与 H2O 反应:2Na+2H2O===2NaOH + H 2↑(3)与酸溶液反应(如 HCl):2Na+2HCl===2NaCl + H 2↑(4)与盐反应①与熔融盐反应如:4Na+TiCl4=====4NaCl+TiNa+KCl=====NaCl+K↑(制取金属钾,因为钾得沸点比钠得低,使钾成为蒸气而逸出)②与盐溶液反应(钠先与水反应,生成得氢氧化钠再与盐溶液反应)如 : 2Na + 2NH4Cl===2NaCl + H 2↑ + 2NH 3↑ 2Na + CuSO4 + 2H2O===Na2SO4 + H 2↑ + Cu(OH)2↓(5)与某些有机物反应如:2Na+2CH3CH2OH―→2CH3CH2ONa+H2↑2Na+2CH3COOH―→2CH3COONa+H2↑ 2. 氧化钠与过氧化钠3. 碳酸钠与碳酸氢钠名称碳酸钠碳酸氢钠俗名纯碱或苏打小苏打主要性质色、态白色粉末白色细小晶体水溶性易溶于水(20 ℃,S=21、5 可溶于水(20 ℃,S=9、6 g)g)稳定性稳 定 , 但 碳 酸 钠 晶 体(Na2CO3·10H2O)易风化受热易分解2NaHCO3=====Na2CO3 + H2O +CO2↑与 H+反应CO+2H+===CO2↑+H2O(较快)HCO + H +===CO2↑ + H2O( 更快)与 NaOH 反应不反应HCO+OH-===CO+H2O主要性质与 Ca(OH)2反应Ca2++CO===CaCO3↓Ca2++2OH-+2HCO===CaCO3↓ + 2H2O +CO(碱不足)或Ca2++OH-+HCO===CaCO3↓ + H2O( 碱 过量)相互转化Na2CO3NaHCO3主要用途用在玻璃、肥皂、合成洗涤剂、造纸、纺织、石油、冶金等工业中灭火器、治疗胃酸过多、发酵粉得主要成分之一二、镁与铝1.镁与铝单质得性质(1)镁得化学性质① 与非金属单质反应(O2、N2、Cl2)2Mg+O2=====2MgO(产生耀眼得白光)3Mg+N2=====Mg3N2 Mg+Cl2=====MgCl2② 与水(反应): Mg+2H2O=====Mg(OH)2+H2↑③ 与酸反应:Mg+2H+===Mg2++H2↑④ 与盐反应:Mg+Cu2+===Mg2++Cu⑤ 与 CO2反应:2Mg+CO2=====2MgO+C⑥工业炼镁:MgCl2=====Mg+Cl2↑(2)铝得化学性质① 与非金属单质反应(O2、Cl2、S)2Al+3Cl2=====2AlCl32Al+3S=====Al2S3(水溶液不存在)② 与酸反应 ③ 与碱反应:2Al+2OH-+2H2O===2AlO+3H2↑④ 与盐反应:Al+3Ag+===Al3++3Ag⑤ 与氧化物反应(铝热反应)2Al+Fe2O3=====2Fe+Al2O3 4Al+3MnO2=====3Mn+2Al2O3Cr2O3+2Al=====2Cr+Al2O3 ⑥工业炼铝:2Al2O3=====4Al+3O2↑3、铝得主要化合物4、“铝三角”间得转化关系 (1)Al3++3OH-===Al(OH)3↓或 Al3++3NH3·H2O===A...