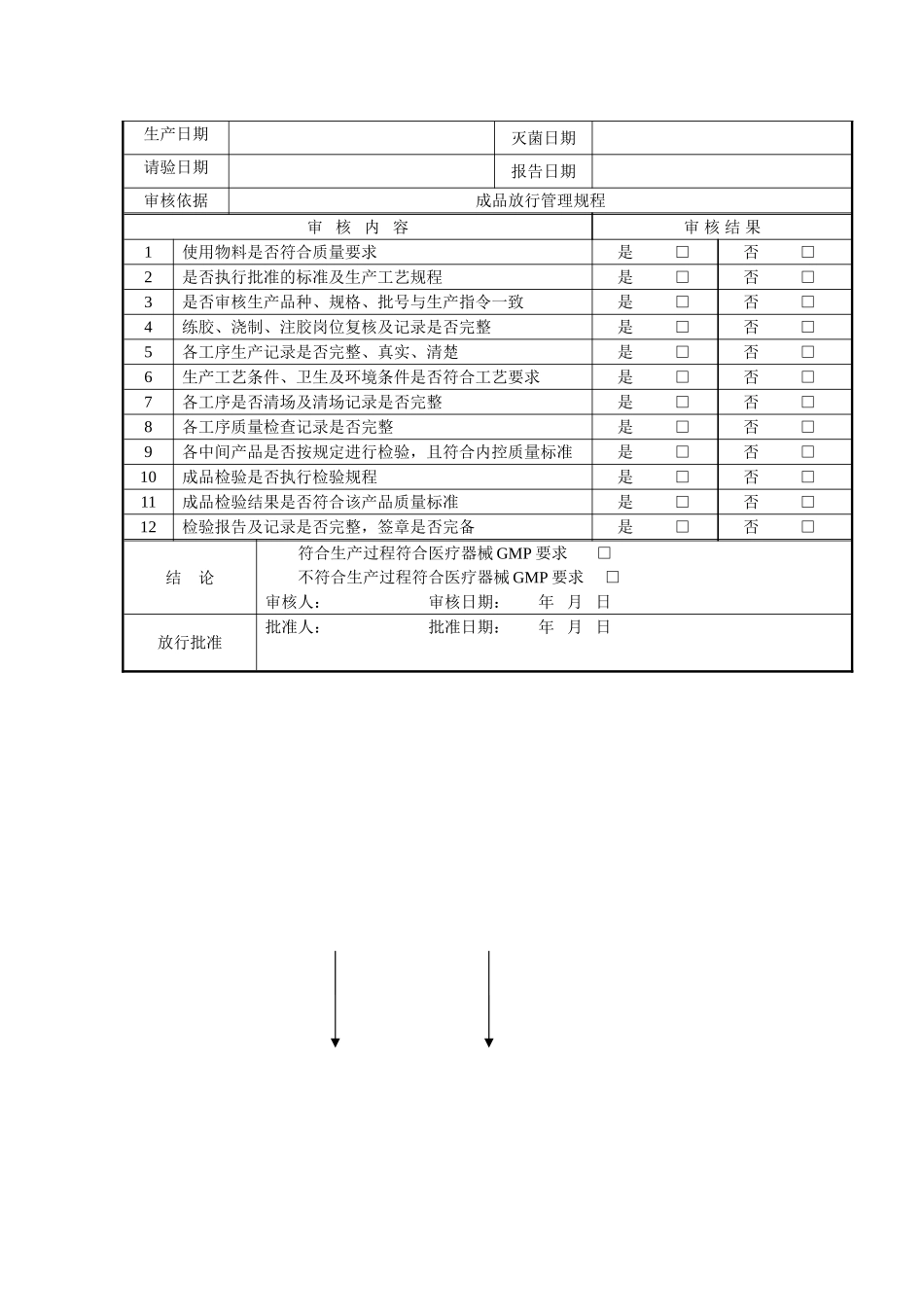
1. 目 的:法律规范成品放行程序,确保出厂产品质量。2. 范 围:适合于本公司所有成品的出厂放行。3。 责 任:生产管理部、质量管理部、销售部、行政部对本规程的实施负责。4。 程 序: 4.1。每批成品放行前,质量管理部要收集、评价一切与该批相关的资料,并经审核无误后批准放行,否则不准放行。4。2 质量管理部根据产品批生产记录及成品检验报告书单,决定对产品的放行与否,只有符合放行条件的产品,质量管理部经理方可签发成品放行单,发放至生产管理部.4。3 生产管理部接到质量管理部发放的成品检验报告单和成品放行单后,应将成品的待验状态标志更换成合格状态标志,并按程序办理产品移交.4.4 行政部成品库核对成品放行单和成品检验报告上,依据成品检验报告上的型号、规格、数量办理入库。4。5 行政部成品库的管理员应及时检查成品的有效期,过效期产品应及时办理报废出库.任何人都不得发放不合格产品(含近效期及包装破损产品)出厂。4.6 成品放行条件4。6.1 产品的成品检验结果是合格的,并经质量管理部经理审核批准.4。6。2 生产该产品的所有原辅料、包装材料、中间产品的检验结果是合格的,并经质量管理部经理审核。4.6。3 生产过程中的偏差、物料平衡及检验偏差符合规定要求.4。6.4 产品的所有生产过程均符合 GMP 要求,且经质量管理部确认签名。4.6。5 产品的批生产记录经生产管理部、质量管理部负责人审核并符合规定要求.4.6.6 提供该产品物料的所有供应商审计符合相关要求。4.7 成品放行审核内容4.7.1 生产管理部初审:成品放行前初审工作首先由生产管理部经理或其授权人担任,授权人应熟悉医疗器械 GMP,且具有实践管理经验。主要审核以下内容。4.7。1.1 领用物料是否经检验合格.4.7。1。2 批记录填写是否法律规范,批记录是否完整。4.7。1。3 生产过程是否符合生产工艺规程的要求;偏差及物料平衡是否符合规定。4。7.1。4 如发生偏差,执行偏差处理程序,处理措施正确、无误,手续齐全,符合要求。4.7.1。5 生产过程操作是否执行标准操作规程.4.7.2 质量管理部审核,主要审核以下内容4。7。2。1 是否执行批准的标准及生产工艺规程。4.7.2。2 配料、称量是否经过复核。4。7。2。3 各工序产品递交审核记录是否完整。4。7。2。4 清场记录是否符合规定.4。7.2。5 生产条件或环境是否得到控制;生产过程是否执行现场监控管理;监控记录与批生产(包装)记录的数据或内容是否相一致。4.7.2.6 中间产品、成...