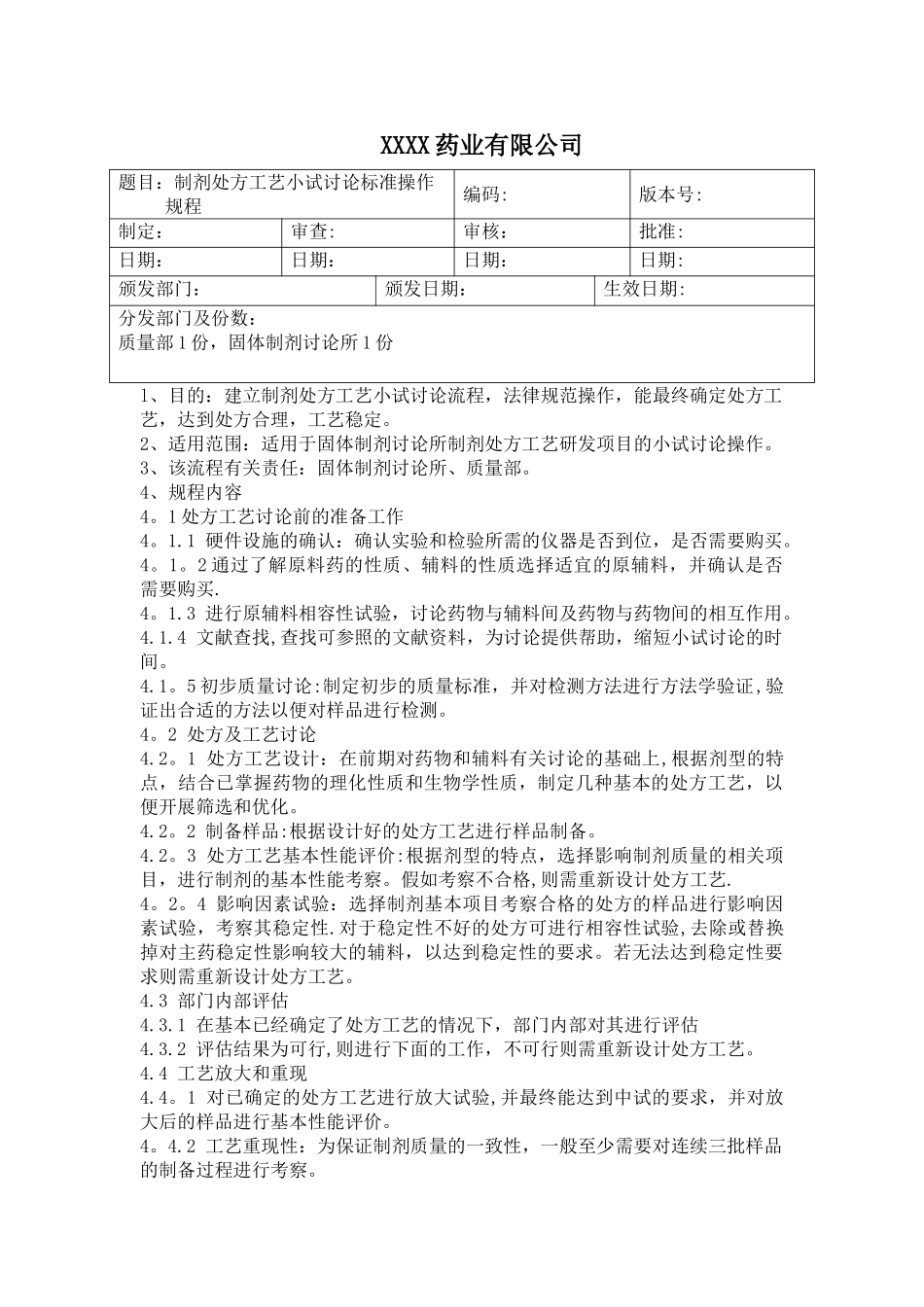
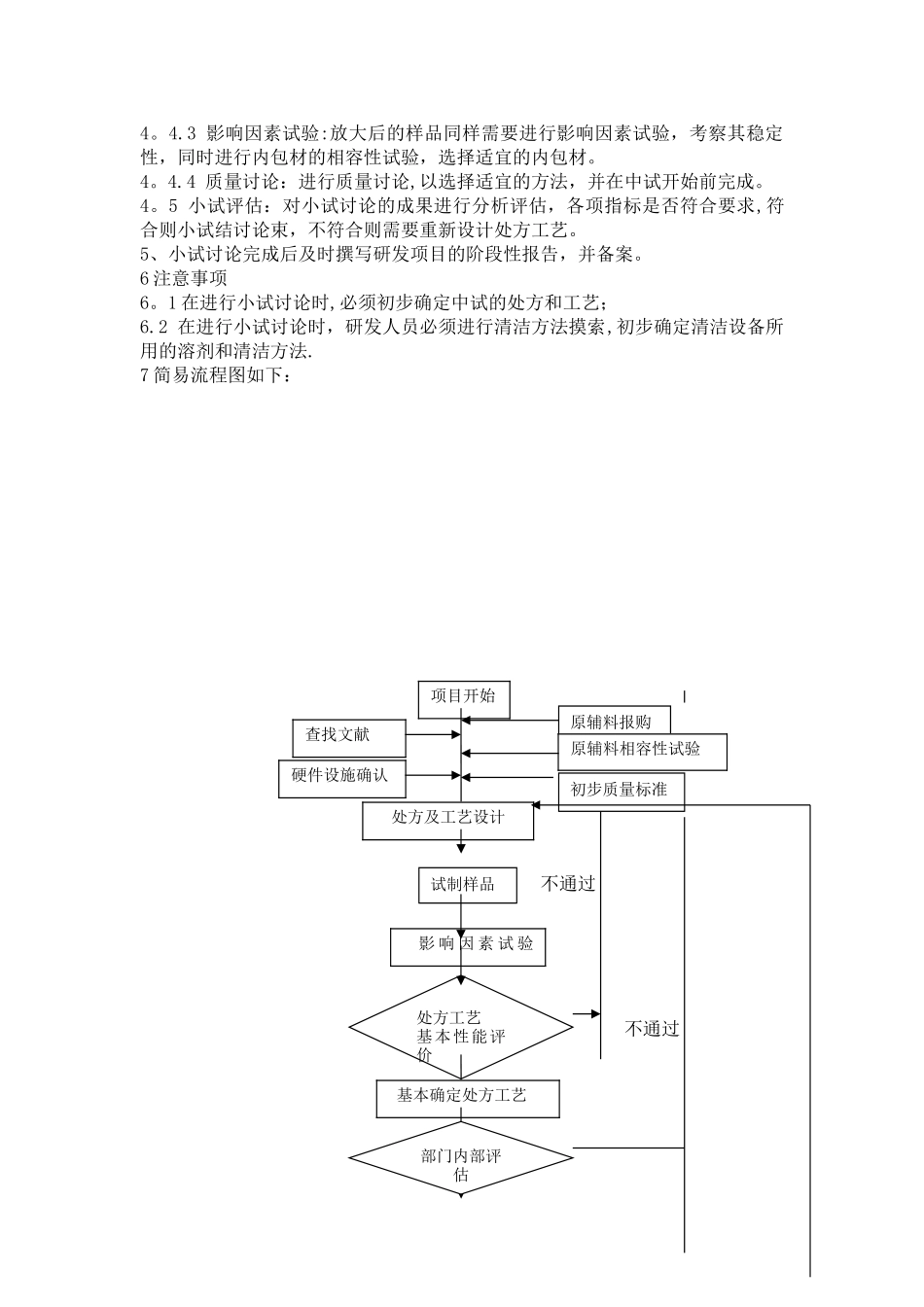
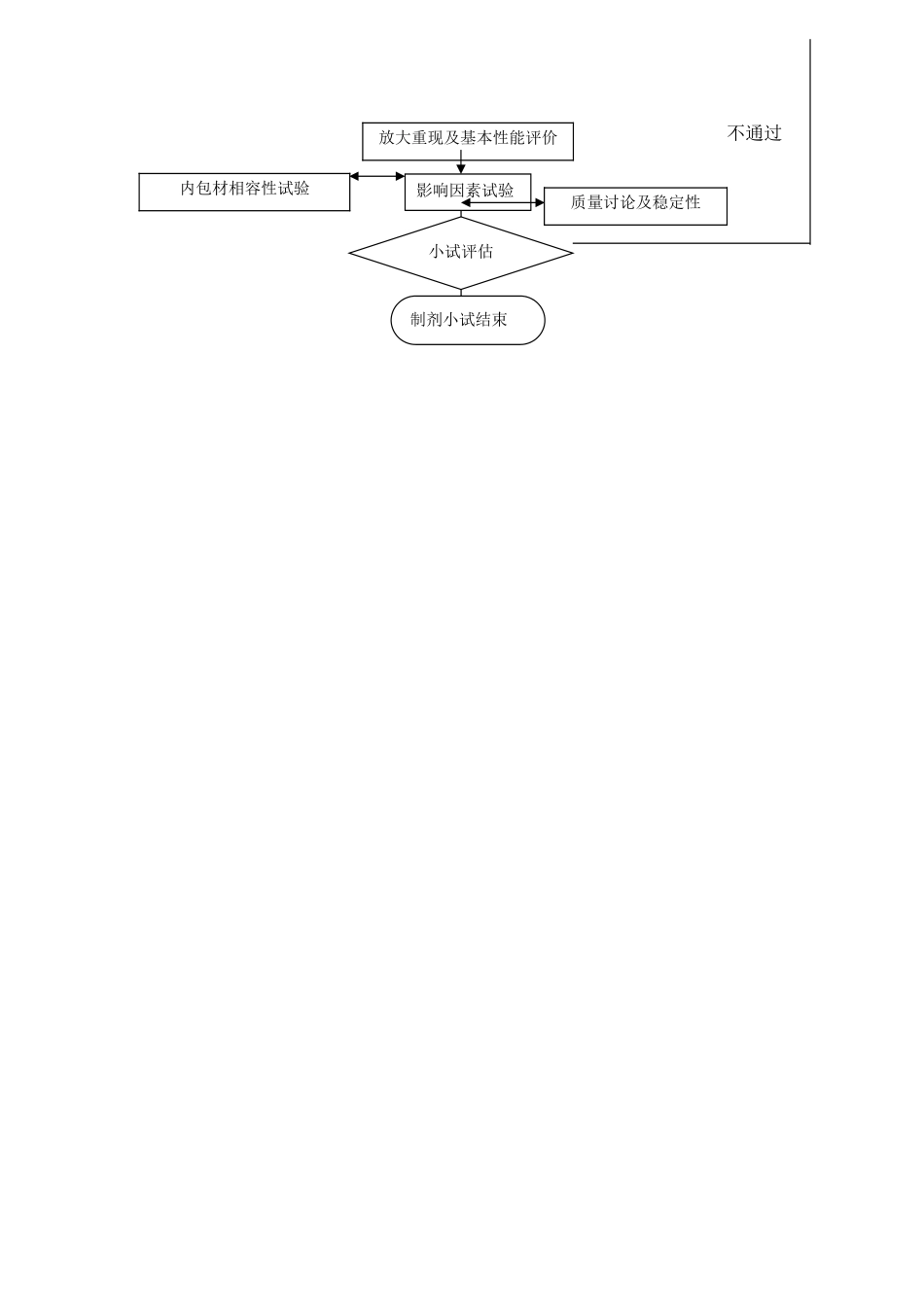
XXXX 药业有限公司题目:制剂处方工艺小试讨论标准操作规程编码: 版本号:制定:审查:审核:批准:日期: 日期: 日期: 日期: 颁发部门: 颁发日期:生效日期: 分发部门及份数:质量部 1 份,固体制剂讨论所 1 份l、目的:建立制剂处方工艺小试讨论流程,法律规范操作,能最终确定处方工艺,达到处方合理,工艺稳定。2、适用范围:适用于固体制剂讨论所制剂处方工艺研发项目的小试讨论操作。3、该流程有关责任:固体制剂讨论所、质量部。4、规程内容4。1 处方工艺讨论前的准备工作4。1.1 硬件设施的确认:确认实验和检验所需的仪器是否到位,是否需要购买。4。1。2 通过了解原料药的性质、辅料的性质选择适宜的原辅料,并确认是否需要购买.4。1.3 进行原辅料相容性试验,讨论药物与辅料间及药物与药物间的相互作用。4.1.4 文献查找,查找可参照的文献资料,为讨论提供帮助,缩短小试讨论的时间。4.1。5 初步质量讨论:制定初步的质量标准,并对检测方法进行方法学验证,验证出合适的方法以便对样品进行检测。4。2 处方及工艺讨论4.2。1 处方工艺设计:在前期对药物和辅料有关讨论的基础上,根据剂型的特点,结合已掌握药物的理化性质和生物学性质,制定几种基本的处方工艺,以便开展筛选和优化。4.2。2 制备样品:根据设计好的处方工艺进行样品制备。4.2。3 处方工艺基本性能评价:根据剂型的特点,选择影响制剂质量的相关项目,进行制剂的基本性能考察。假如考察不合格,则需重新设计处方工艺.4。2。4 影响因素试验:选择制剂基本项目考察合格的处方的样品进行影响因素试验,考察其稳定性.对于稳定性不好的处方可进行相容性试验,去除或替换掉对主药稳定性影响较大的辅料,以达到稳定性的要求。若无法达到稳定性要求则需重新设计处方工艺。4.3 部门内部评估4.3.1 在基本已经确定了处方工艺的情况下,部门内部对其进行评估4.3.2 评估结果为可行,则进行下面的工作,不可行则需重新设计处方工艺。4.4 工艺放大和重现4.4。1 对已确定的处方工艺进行放大试验,并最终能达到中试的要求,并对放大后的样品进行基本性能评价。4。4.2 工艺重现性:为保证制剂质量的一致性,一般至少需要对连续三批样品的制备过程进行考察。4。4.3 影响因素试验:放大后的样品同样需要进行影响因素试验,考察其稳定性,同时进行内包材的相容性试验,选择适宜的内包材。4。4.4 质量讨论:进行质量讨论,以选择适宜的方法,并在中试开始前完成。4。5 小试...