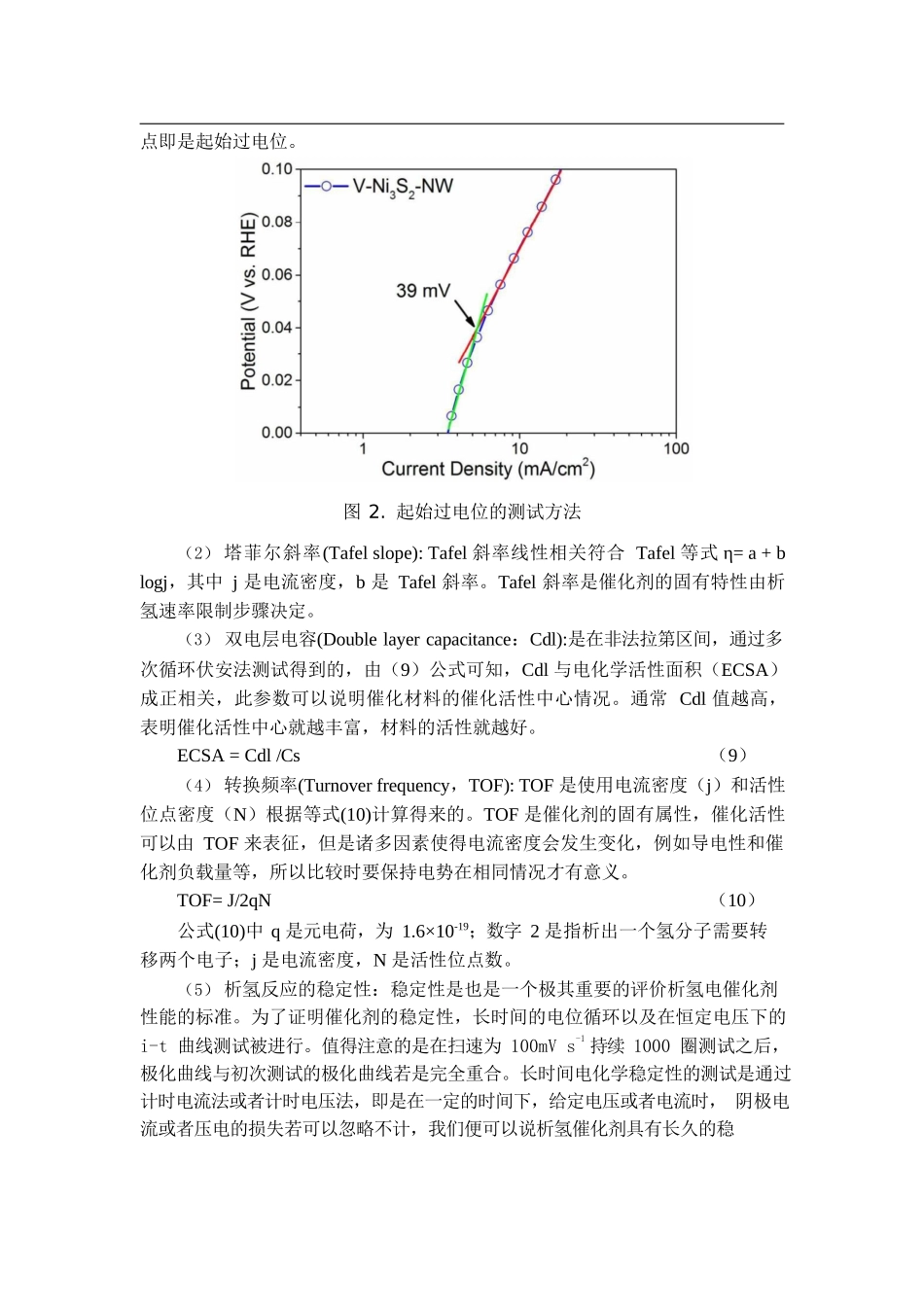
CS 电化学工作站应用案例-电催化析氢方向一、前言1.1 背景进入 21 世纪以来,随着人类社会的快速发展,对能源的需求越来越大,能源也成为了国家间竞争的焦点。人类相关的物质活动也离不开能源的支持。现如今,能源短缺、有限能源的争夺以及能源的过度使用等一系列问题,无一不威胁着人类的生存与发展。目前,社会发展主要依赖的能源是以煤、石油、天然气为代表的传统化石燃料,然而,化石燃料的不可再生性、资源有限性制以及带来的环境污染问题制约了现代经济的发展。因此,人们开始认识到开发探索新能源是满足能源需求和解决环境污染问题的唯一出路。而氢能作为一种理想的二次能源以及其清洁、高效、可储存和便于运输等优点,被视为替代煤炭、石油和天然气等不可再生能源最为理想的能源载体。目前,工业上制备氢气的方法主要包括化石燃料制氢、水电解制氢、热解水制氢和生物制氢等方法。其中电解水制氢以其产品纯度高、电解效率高、无污染等诸多优点被广泛采用。由此可见,制备一种高效稳定的电解水制氢材料,是解决能源危机和环境污染的重要途径。1.2 原理电催化反应发生在电极与电解液的固液界面层,在酸碱电解液中各有不同的反应式和不同的反应机理,如下反应等式所示:酸性电解液:阳极: H2O → 2H+ + 1/2O2 + 2e-(1)阴极: 2H+ + 2e- → H2(2)碱性电解液:阳极: 2OH- + H2O + 1/2O2 + 2e-(3)阴极: 2H2O + 2e → H2 + 2OH- (4)总反应: H2O →H2 + 1/2O2(5)由等式(1-5)可知,无论是在酸性电解液还是碱性电解液,吸附在阴极催化剂表面氢原子得两个电子生成一个氢分子,而阳极则发生氧化反应,不断有氧气析出。所以电解过程中,水不断因为电解而减少并且生成了气体,从而电解液的溶度不断提高。上世纪就提出很多关于氢在阴极电解时的机理,虽然有很多争论,但它们的共同点部分有以下几方面:第一步主要是放电步骤(Volmer 反应):H3O+ + e- → Hads + H2O(6)3ads32第二步既是电化学解吸步骤(Heyrovsky 反应)H + H O+ + e- → H + H O(7)或者是重组步骤(Tafel 反应):Hads + Hads → H2(8)从反应机理等式(6-8)和图 1 阴极电解原理图(1-4)可以知道,水合氢离子吸附到催化剂的表面形成催化剂与氢原子的中间体,然后水合氢离子通过 Heyrovsky 反应和 Tafel 反应生成氢气。一般催化剂在酸性电解液的活性相对于碱性环境中活性更高,这是因为在酸性环境中...