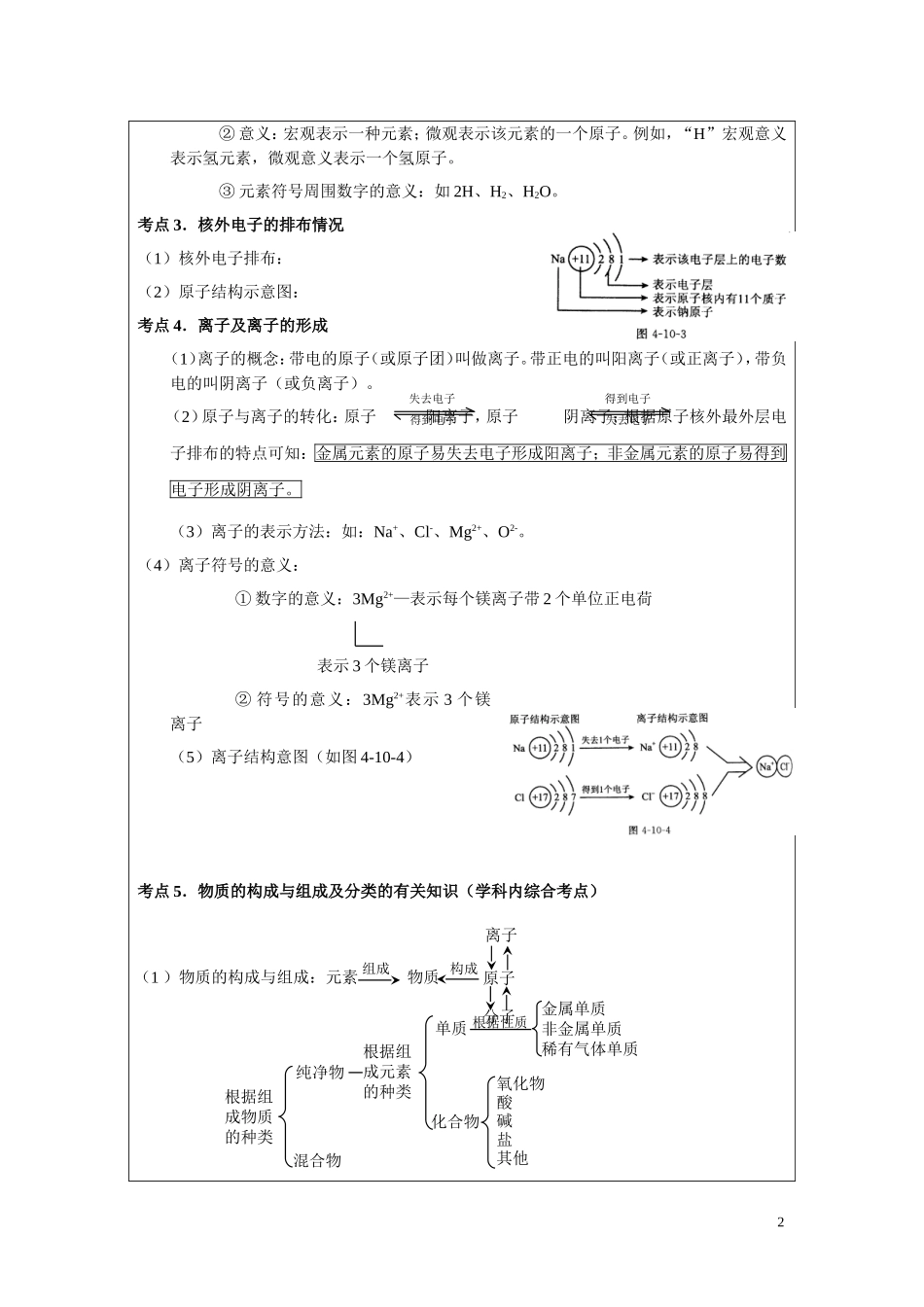
武汉赋迪个性化辅导教案 教学标题物质构成的奥秘、化合价、化学式教学目标原子的构成、元素周期表、化学式、元素的化合价、元素的化合价与化学式的关系、相对分子质量及其计算教学重难点化学方程式上次作业检查授课内容:物质构成的奥秘考点 1.原子的构成(1)原子结构 ② 不同种类的原子,核内的质子数不同,核外的电子数也不同。 ③ 在原子中,核电荷数=质子数=核外电子数。因此,整个原子呈电中性。④ 原子核内的质子数不一定等于中子数,原子核也可以没有中子,比如 H 原子。(2)相对原子质量:考点 2.元素与元素符号(1)元素:① 定义:具有相同核电荷数(即核内质子数)的一类原子的总称。② 决定:质子数决定了元素的种类,不同元素的区别是因为它们的质子数不相同。③ 性质:a. 元素是个宏观概念;b. 元素只讲种类不讲个数;④ 分类:元素可分为金属元素、非金属元素和稀有气体元素三大类。⑤ 含量:a. 在地壳中,氧元素最多,其次为硅、铝、铁等元素;b. 在空气中,氮元素最多,其次是氧元素;c. 在生物体中,氧元素最多,其次是碳元素和氢元素。由原子构成的物质有:金属单质 Na、Mg、Al、Fe 等;很多固态非金属单质 S、C、P 等。由分子构成的物质有:气态非金属单质如 H2、O2、N2、Cl2 等;非金属氧化物CO2 、CO、SO2、NO2等(2)元素符号:① 写法:第一个字母的大写,第二个字母小写。如 Cu1① 原子原子核核外电子:每个电子带一个单位的负电荷质子:每个质子带一个单位的正电荷中子:不显电性② 意义:宏观表示一种元素;微观表示该元素的一个原子。例如,“H”宏观意义表示氢元素,微观意义表示一个氢原子。③ 元素符号周围数字的意义:如 2H、H2、H2O。考点 3.核外电子的排布情况(1)核外电子排布:(2)原子结构示意图:考点 4.离子及离子的形成(1)离子的概念:带电的原子(或原子团)叫做离子。带正电的叫阳离子(或正离子),带负电的叫阴离子(或负离子)。(2)原子与离子的转化:原子 阳离子,原子 阴离子;根据原子核外最外层电子排布的特点可知:金属元素的原子易失去电子形成阳离子;非金属元素的原子易得到电子形成阴离子。(3)离子的表示方法:如:Na+、Cl-、Mg2+、O2-。(4)离子符号的意义:① 数字的意义:3Mg2+—表示每个镁离子带 2 个单位正电荷 表示 3 个镁离子② 符号的意义:3Mg2+表示 3 个镁离子(5)离子结构意图(如图 4-10-4)考点 5.物质的构...