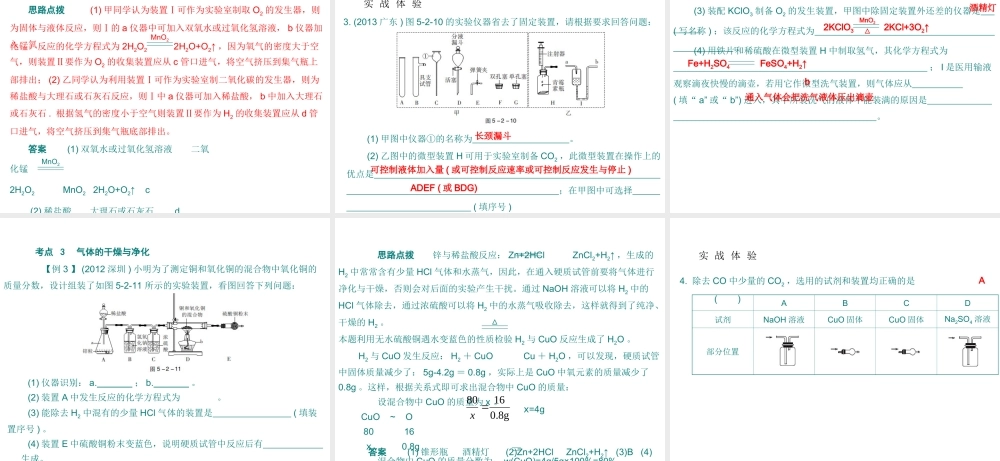
第五部分 基本实验和科学探究第二节 常见气体的制取 要 点 梳 理 ● 要点 1 实验室制取气体的思路:原理、装置、收集 1. 原理:能够生成气体的某个化学反应。 2. 实验装置: 实验室制取气体的装置由 和 两部分组成。 (1) 气体的发生装置:一般根据 和 来确定。 ①“固固加热型”:反应物为固体 ( 或固体混合物 ) ,反应需加热。如加热高锰酸钾或氯酸钾与二氧化锰混合物制氧气的发生装置应选择图 5-2-1 装置; ②“固液常温型”:反应物是块状固体和液体,反应不需加热。如制 H2或 CO2 或用 MnO2 与 H2O2 的混合物制 O2 的发生装置应选择图 5-2-2 装置。发生装置收集装置反应物的状态反应条件 (2) 气体收集装置:根据气体的 和 来确定。 收集气体的常用方法有: ①排水法:气体 ,且不与 反应 ( 如图 5-2-3 中 a) 。 ②向上排空气法:气体的密度比空气 ,且不与 反应 ( 如图5-2-3 中 b) 。 ③向下排空气法:密度比空气 ,且不与 反应 ( 如图 5-2-3中 c) 。 ④其他方法: 若气体不溶于水,采用如图 5-2-3 中 d 的方法收集,该方法的实质还是排水法;小氧气密度溶解性难溶于水水大氧气 若气体密度比空气大,采用如图 5-2-3 中 e 的方法收集,气体进出顺序:“长进短出”; 若气体密度比空气小,采用如图 5-2-3 中 f 的方法收集,气体进出顺序:“短进长出”。 注意:若要收集干燥气体,则选择排空气法收集;若要收集较为纯净的气体,则选择排水法。● 要点 2 三种气体的实验室制法对比( 用图 5-2-4 中的装置序号回答 ) CO2 H2 O2收集装置 发生装置 反应的化学方程式 气体 CDAAABBCDCDCED2KClO3 2KCl + 3O2↑催化剂Zn + H2SO4 ZnSO4 + H2↑CaCO3 + 2HCl CaCl2 + CO2↑ + H2O2H2O2 2H2OMnO22KMnO4 K2MnO4 + MnO2 + O2↑△ 注意事项: (1) 制取气体前一定要检查装置的 。 (2) 用高锰酸钾制氧气时,试管口要塞一小团 ,以防止 . 。 (3) 用高锰酸钾制氧气时,试管口要向 倾斜,以防止 . 。 (4) 实验室制取 CO2 时不能用稀 H2SO4 代替稀 HCl ,因为 . 。 (5) 实验室制取 CO2 时不能用稀 HCl 与 Na2CO3 ,因为 . 。气密性棉花高锰酸钾下产生的水蒸气稀硫酸与碳酸钙反应速度太快,难以反应生成的硫酸钙微溶于水,覆盖在碳酸钙表面阻止反应继续发生冷却后倒流使试管炸裂粉末堵塞导管 ...