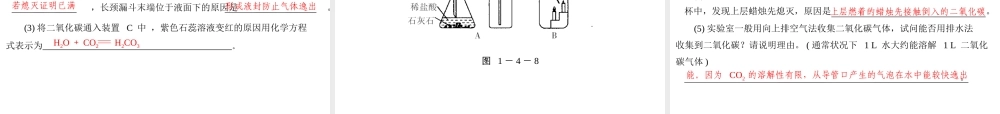
第四节碳和碳的氧化物石墨金刚石● 要点 1 碳的单质1. 碳的单质主要包括:、和 C60 ,它们都是由碳元素组成的单质。原子的排列方式不同,2. 碳的几种单质的物理性质有很大的差异,原因是但它们的化学性质相同。 要 点 梳 理 碳单质物理性质用途金刚石能作钻探机的钻头石墨作电池的电极作铅笔芯的原料可用于打开生锈的锁活性炭用于防毒面具滤毒罐中C60能用作超导体3. 碳单质的物理性质和用途:硬度最大,无色透明的正八面体导电性质软润滑性吸附性在超低温度状态下电阻极小碳的化学性质 ( 用化学方程式表示 )用途常温下化学性质稳定,不易变质可燃性;还原性4. 碳单质的化学性质和用途:C + O2CO2点燃2C + O22CO点燃C + 2CuO2Cu + CO2↑高温墨水书写档案、作画作燃料冶炼金属,作还原剂物理性质无色无味的气体,密度比空气的 ; 溶于水;干冰是化学性质①“ 三不”:不能 ,不 ,不能供给呼吸。检验地窖中CO2 含量的方法:② 与水反应: ,石蕊溶液变 色将溶液加热, ,石蕊溶液由红色变成 色③ 与碱反应 ( 化学方程式 )④ 与碳反应: , 该反应 热● 要点 2 二氧化碳的性质大可固体的二氧化碳燃烧支持燃烧灯火实验红紫吸CO2 + H2O H2CO3H2CO3 H2O + CO2↑C + CO2 2COCO2+Ca(OH)2 CaCO3↓ + H2O2NaOH+CO2 Na2CO3 + H2OCO2 的用途和危害① 干冰作制冷剂,用于 ,原理是②CO2 可用于灭火,利用了 CO2 的三条性质: 、 、③CO2 可以作为气体肥料的原因:④ 大气中 CO2 含量增加,造成 ,给人类带来危害● 要点 3 二氧化碳的用途与危害制冷干冰“升华”时吸收大量的热不能燃烧 不能助燃密度比空气大促进植物进行光合作用温室效应● 要点 4 二氧化碳的实验室制法图 1 - 4 - 1图 1 - 4 - 1 是实验室制取 CO2 的操作过程,(1) 原料名称:和。。浑(2) 反应原理 ( 化学方程式 ) :(3) 验证二氧化碳的方法:将气体通入澄清的石灰水中,出现浊现象,证明是二氧化碳气体,发生反应的化学方程式为。验满方法是。(4) 收集 CO2 的方法是,因为 CO2 的密度且 CO2,所以 CO2 不能用排水法收集。石灰石 ( 大理石 )稀盐酸白色CO2 + Ca(OH)2)CaCO3↓ + H2O将燃烧的木条放在瓶口,若木条熄灭则表示气体已经收集满CaCO3 + 2HClCaCl2 + CO2↑ + H2O向上排空气法比空气的大可溶于水CO 的物理性质密度比空气 ; 溶于水。...