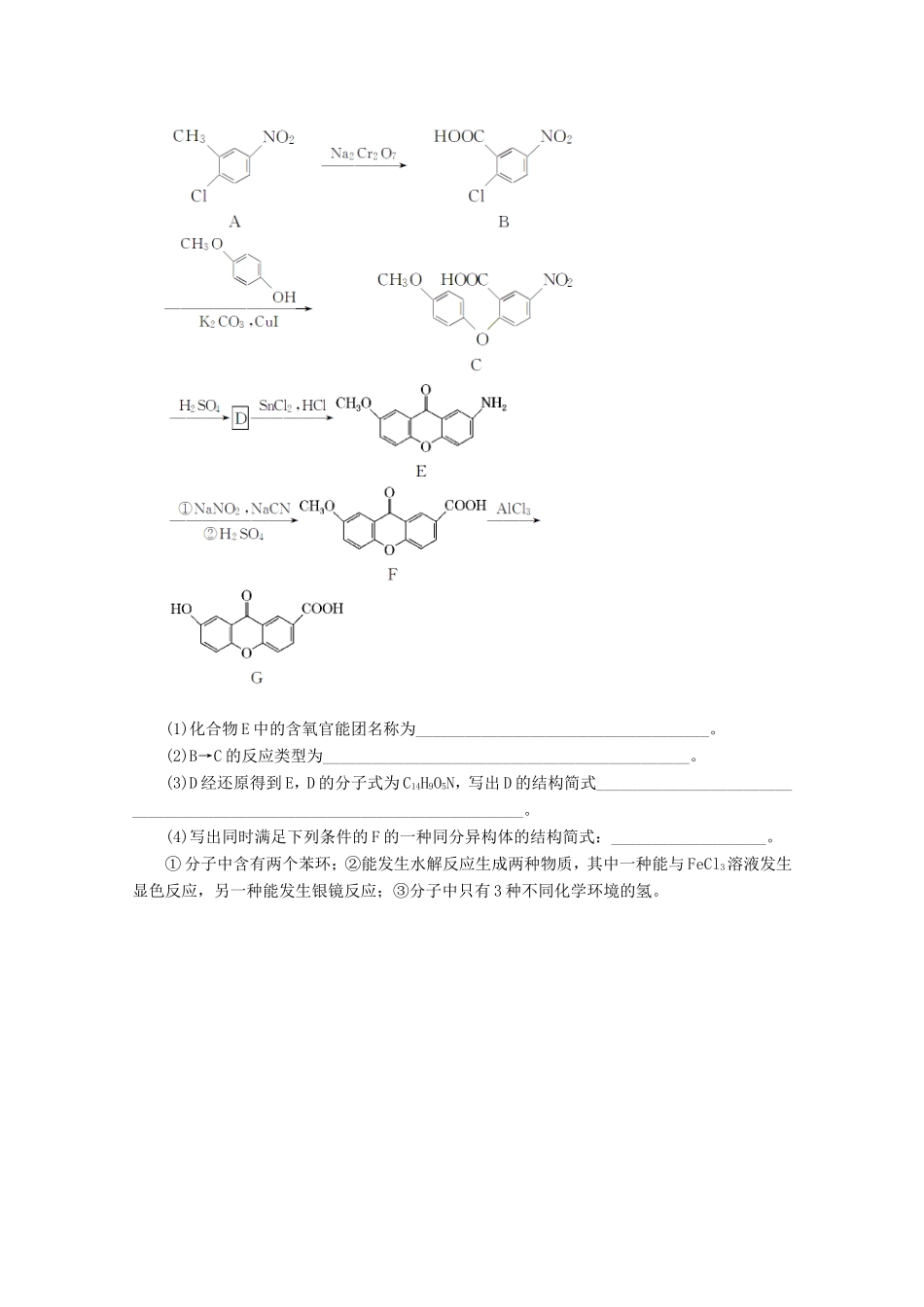
6道主观大题组合练(三)16.硫酸锰在电解锰、染料、造纸以及陶瓷等工业生产中有广泛的应用。利用软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS)制得硫酸锰的流程如下:(1)“酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是________;MnO2、ZnS及硫酸反应转变为两种硫酸盐的化学方程式为________________________________________________________________________________________________________________________________________________。(2)常温下,Ksp(ZnS)=1.2×10-24,Ksp(MnS)=1.5×10-15,“沉锌”反应为Zn2+(aq)+MnSZnS+Mn2+(aq),该反应的平衡常数K=________。(3)在强酸性条件下加入MnO2氧化Fe2+的离子方程式为________________________。(4)“除铁”时需要调节pH约为3~4,过滤所得的滤渣2中除MnO2以外的另一种物质是__________________。(写化学式)(5)该工艺流程中可以循环利用的物质是________。解析:由流程图分析可知:软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS)用稀硫酸浸取后形成两种硫酸盐,+4价的锰被还原为+2价,-2价的硫被氧化为+6价,根据氧化还原反应规律进行配平即可;加入MnS使Zn2+沉淀,生成的ZnS可循环利用;加入MnO2除去溶液中的铁,MnO2中+4价的锰被还原为+2价,溶液中Fe2+被氧化,并调节pH约为3~4,铁则形成Fe(OH)3沉淀,滤渣2即为多余的MnO2和Fe(OH)3。(1)“酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是催化剂;MnO2、ZnS及硫酸反应转变为两种硫酸盐的化学方程式为4MnO2+ZnS+4H2SO4===4MnSO4+ZnSO4+4H2O。(2)常温下,Ksp(ZnS)=1.2×10-24,Ksp(MnS)=1.5×10-15,“沉锌”反应为Zn2+(aq)+MnSZnS+Mn2+(aq),该反应的平衡常数K====1.25×109。(3)在强酸性条件下加入MnO2氧化Fe2+的离子方程式为MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O。(4)“除铁”时需要调节pH约为3~4,过滤所得的滤渣2中除MnO2以外的另一种物质是Fe(OH)3。(5)该工艺流程中可以循环利用的物质是ZnS。答案:(1)催化剂4MnO2+ZnS+4H2SO4===4MnSO4+ZnSO4+4H2O(2)1.25×109(3)MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O(4)Fe(OH)3(5)ZnS17.化合物G是合成抗过敏药喘乐氧蒽酸的中间体,可通过以下方法合成:(1)化合物E中的含氧官能团名称为____________________________________。(2)B→C的反应类型为_____________________________________________。(3)D经还原得到E,D的分子式为C14H9O5N,写出D的结构简式________________________________________________________________________。(4)写出同时满足下列条件的F的一种同分异构体的结构简式:___________________。①分子中含有两个苯环;②能发生水解反应生成两种物质,其中一种能与FeCl3溶液发生显色反应,另一种能发生银镜反应;③分子中只有3种不同化学环境的氢。解析:(1)化合物E中的含氧官能团名称为醚键、羰基(酮基)。(2)B和C发生取代反应生成C()。(3)D经加氢还原得到E,根据D的分子式为C14H9O5N,可知D的结构简式为。(4)①分子中含有两个苯环;②能发生水解反应生成两种物质,其中一种能与FeCl3溶液发生显色反应,另一种能发生银镜反应;说明水解产物里一种物质中含有酚羟基,另一产物中含有醛基;③分子中只有3种不同化学环境的氢,说明结构对称性比较强;F同时满足上列条件的一种同分异构体的结构简式为。答案:(1)醚键、羰基(酮基)(2)取代反应(3)18.草酸(二元弱酸,分子式为H2C2O4)遍布于自然界,几乎所有的植物都含有草酸钙(CaC2O4)。(1)葡萄糖(C6H12O6)与HNO3反应可生成草酸和NO,其化学方程式为________________________________________________________________________________________________________________________________________________。(2)相当一部分肾结石的主要成分是CaC2O4。若某人每天排尿量为1.4L,含0.10gCa2+。当尿液中c(C2O)>________mol·L-1时,易形成CaC2O4沉淀。[已知Ksp(CaC2O4)=2.3×10-9](3)测定某草酸晶体(H2C2O4·xH2O)组成的实验如...