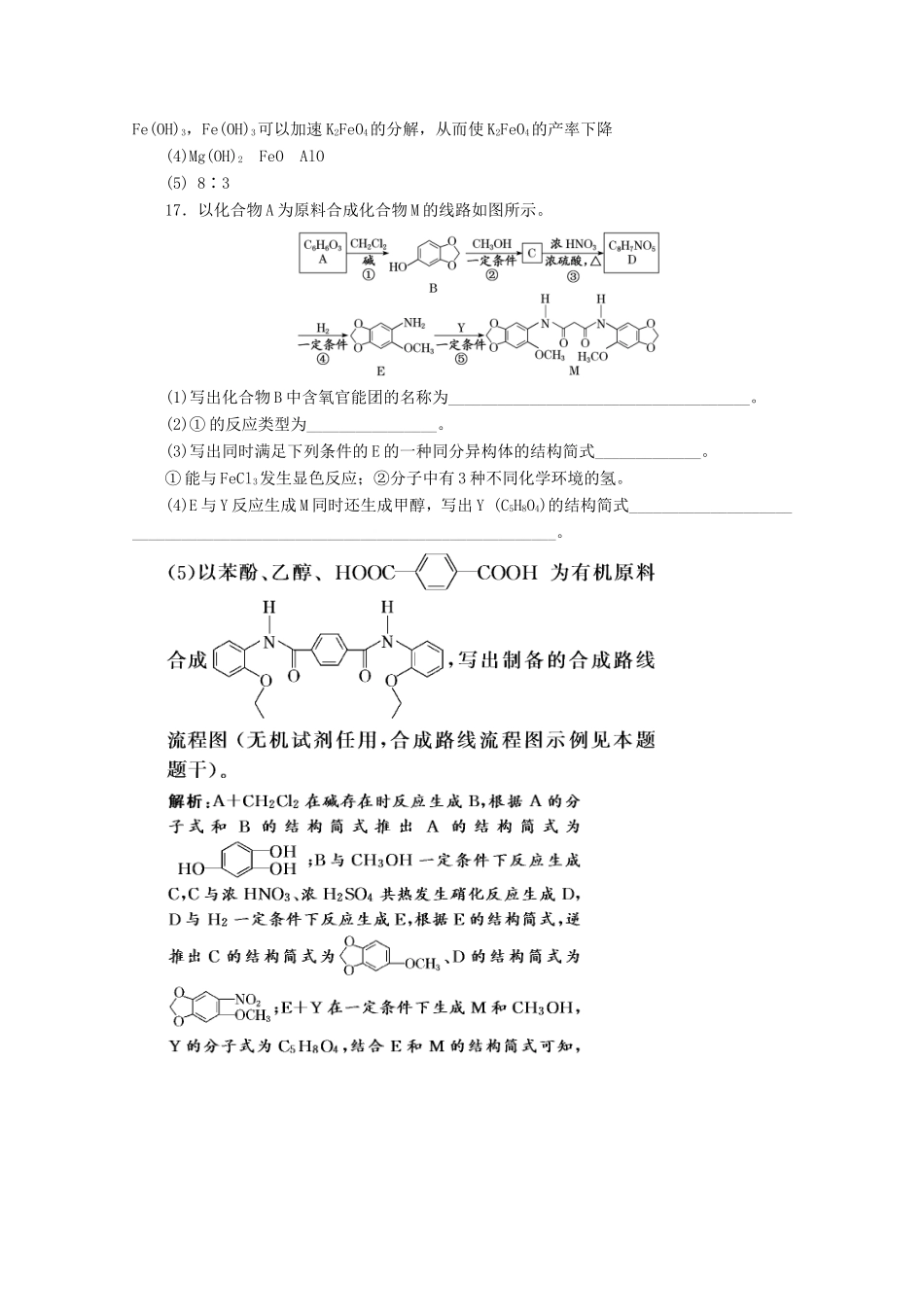
6道主观大题组合练(一)16.以硫铁矿烧渣(主要成分Fe2O3、SiO2,少量的Fe3O4、Al2O3、MgO)生产安全高效的水处理剂高铁酸钾(K2FeO4)的工艺流程如下:已知:FeO在强碱性溶液中稳定,但在Fe(OH)3催化作用下会发生分解。(1)“酸浸”时加入硫酸的量不宜过多的原因是_________________________________________________________________________________________________________。(2)“氧化”时发生反应的离子方程式为____________________________________。(3)在控制其他条件不变的情况下,探究保持Fe2(SO4)3和NaOH总质量不变,改变其质量比对K2FeO4产率的影响,实验结果如图所示,当质量比大于0.55时K2FeO4的产率下降的原因可能是_______________________________________________。(4)“过滤2”产生的滤渣的主要成分为________(填化学式),“过滤3”所得滤液中含有的阴离子有OH-、Cl-、SO、____________、____________(填化学式)。(5)K2FeO4可将水中的H2S氧化为硫酸盐,同时K2FeO4被还原为Fe(OH)3,则反应时K2FeO4与H2S的物质的量之比为________。解析:硫铁矿烧渣中加入稀硫酸、过氧化氢,滤渣为二氧化硅,滤液中含有铁离子、铝离子、硫酸根离子和镁离子,加入次氯酸钠溶液和氢氧化钠溶液,混合发生氧化还原反应生成高铁酸钠、氯化钠和水,过滤除去氢氧化镁,滤液中加入饱和氢氧化钾溶液实现高铁酸钠转化为高铁酸钾沉淀,冷却结晶过滤得到高铁酸钾固体,滤液中含有的阴离子有OH-、Cl-、SO、FeO、AlO,上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯。(1)为避免后续反应消耗较多的氢氧化钠,则“酸浸”时加入硫酸的量不宜过多。(2)“氧化”时发生反应的离子方程式为2Fe3++3ClO-+10OH-===2FeO+3Cl-+5H2O。(3)题给信息中FeO在强碱性溶液中稳定,但在Fe(OH)3催化作用下会发生分解,由图像可知,当质量比大于0.55时,过多的Fe3+与NaOH反应生成Fe(OH)3,Fe(OH)3可以加速K2FeO4的分解,从而使K2FeO4的产率下降。(4)滤渣2含有氢氧化镁,“过滤3”所得滤液中含有的阴离子有OH-、Cl-、SO2、FeO2、AlO。(5)反应中Fe元素化合价由+6价降低为+3价,S元素化合价由-2价升高为+6价,根据化合价升降总数相等可得,K2FeO4与H2S的物质的量之比为8∶3。答案:(1)可以减少“氧化”步骤中NaOH的用量(2)2Fe3++3ClO-+10OH-===2FeO+3Cl-+5H2O(3)当硫酸铁跟氢氧化钠的质量比增大到一定程度时,过多的Fe3+与NaOH反应生成Fe(OH)3,Fe(OH)3可以加速K2FeO4的分解,从而使K2FeO4的产率下降(4)Mg(OH)2FeOAlO(5)8∶317.以化合物A为原料合成化合物M的线路如图所示。(1)写出化合物B中含氧官能团的名称为_____________________________________。(2)①的反应类型为________________。(3)写出同时满足下列条件的E的一种同分异构体的结构简式_____________。①能与FeCl3发生显色反应;②分子中有3种不同化学环境的氢。(4)E与Y反应生成M同时还生成甲醇,写出Y(C5H8O4)的结构简式________________________________________________________________________。答案:(1)羟基、醚键(2)取代反应(4)CH3OOCCH2COOCH3(5)18.工厂化验员检验某含有KBrO3、KBr及惰性物的样品。化验员称取了该固体样品1.000g,加水溶解后配成100mL溶液X。Ⅰ.取25.00mL溶液X,加入稀硫酸,然后用Na2SO3将BrO还原为Br-;Ⅱ.去除过量的SO后调至中性;Ⅲ.加入K2CrO4作指示剂,用0.1000mol·L-1AgNO3标准溶液滴定Br-至终点,消耗AgNO3标准溶液11.25mL;Ⅳ.另取25.00mL溶液X,酸化后加热,再用碱液调至中性,测定剩余Br-,消耗上述AgNO3标准溶液3.75mL。已知:①25℃时,Ag2CrO4(砖红色)的Ksp=1.12×10-12,AgBr(浅黄色)的Ksp=5.0×10-15;②Ⅳ中酸化时发生反应:BrO+5Br-+6H+===3Br2+3H2O请回答:(1)步骤Ⅰ中,反应的离子方程式为________________________________。(2)步骤Ⅲ中,滴定终点的现象为_____________________________________________。(3)步骤Ⅳ中,加热的目的是____________________。(4)计算试样中KBrO3质量分数。(写出计算过程,结果保留3位有效数字)解析:(1)步骤Ⅰ中,“加入稀硫酸,然后...