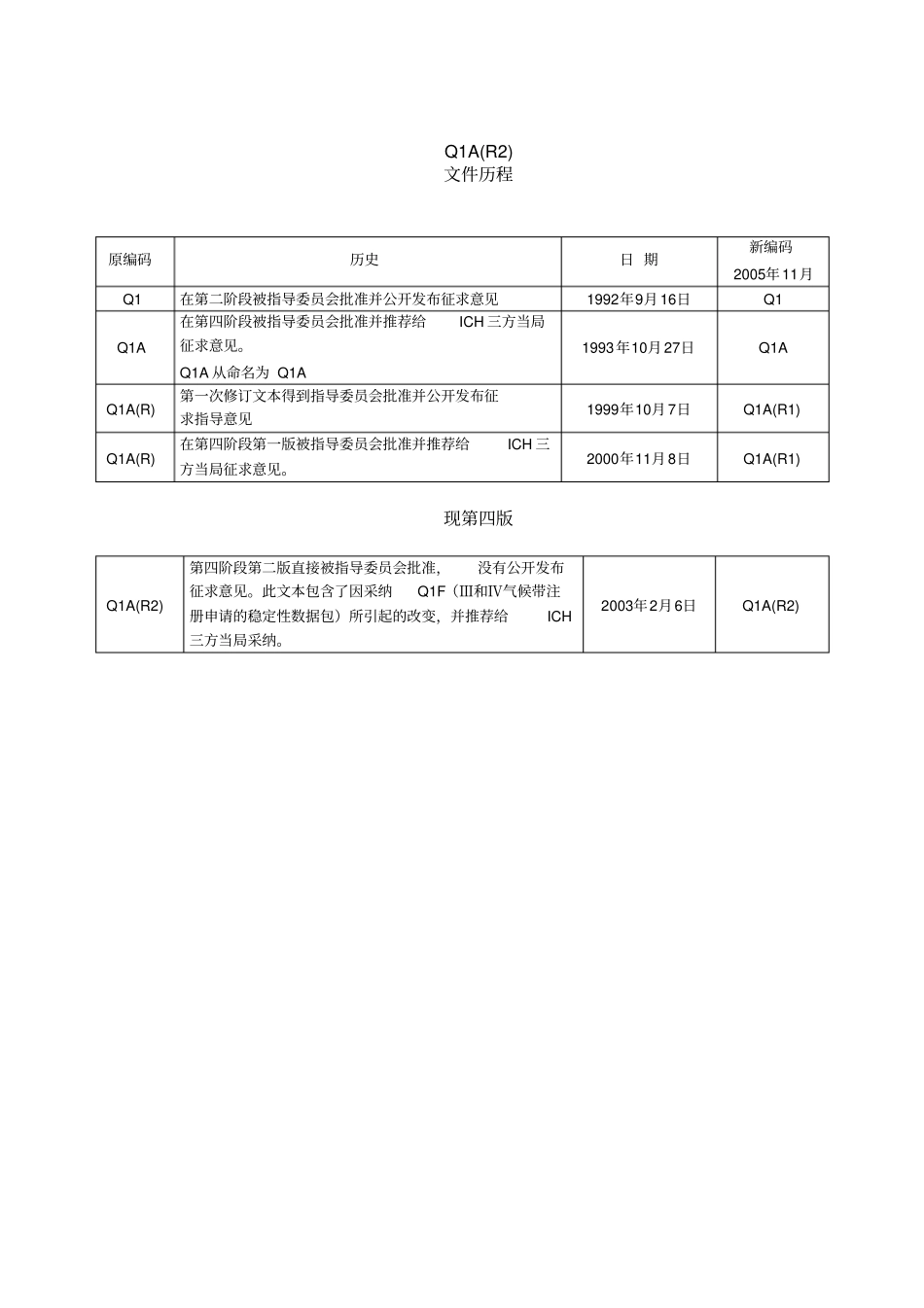
人用药品注册技术要求国际协调会ICH三方指导文件新原料药和制剂的稳定性试验Q1A(R2)现第四版2003年2月6日制定Q1A(R2)文件历程原编码历史日期新编码2005年11月Q1在第二阶段被指导委员会批准并公开发布征求意见1992年9月16日Q1Q1A在第四阶段被指导委员会批准并推荐给ICH三方当局征求意见。Q1A从命名为Q1A1993年10月27日Q1AQ1A(R)第一次修订文本得到指导委员会批准并公开发布征求指导意见1999年10月7日Q1A(R1)Q1A(R)在第四阶段第一版被指导委员会批准并推荐给ICH三方当局征求意见。2000年11月8日Q1A(R1)现第四版Q1A(R2)第四阶段第二版直接被指导委员会批准,没有公开发布征求意见。此文本包含了因采纳Q1F(Ⅲ和Ⅳ气候带注册申请的稳定性数据包)所引起的改变,并推荐给ICH三方当局采纳。2003年2月6日Q1A(R2)新原料药和制剂的稳定性试验Q1A(R)修订说明本修订的目的为了明确由于采用了ICHQ1F“在气候带Ⅲ和Ⅳ注册申请的稳定性数据包”而使Q1A(R)而产生的变更。这些变更如下:1.在下面章节中将中间储存条件从温度30℃±2℃/相对湿度60%±5%修改为温度30℃±2℃/相对湿度65%±5%:2.1.7.1原料药-储存条件-一般情况2.2.7.1制剂-储存条件-一般情况2.2.7.3在半渗透性容器中包装的制剂3术语-“中间试验”2.在下面章节中可以使用温度30℃±2℃/相对湿度65%±5%替代温度25℃±2℃/相对湿度60%±5%作为长期稳定性试验的条件:2.1.7.1原料药-储存条件-一般情况2.2.7.1制剂-储存条件-一般情况3.在温度25℃±2℃/相对湿度40%±5%的基础上增加了温度30℃±2℃/相对湿度35%±5%作为长期稳定性试验条件,并且在后面的章节中包括了失水比率相关举例的相关情况:2.2.7.3在半透性容器中包装的制剂在试验阶段中间将中间将储存条件从温度30℃±2℃/相对湿度60%±5%调整为温度30℃±2℃/相对湿度65%±5%是可以的,但相应的储存条件和调整的日期要在注册申报资料中清楚地说明和列出。如果适用的话建议ICH三方在公布和执行此修订指南三年后,注册申请资料中完整的试验能够包含在中间储存条件,即温度30℃±2℃/相对湿度65%±5%下的实验资料。STABILITYTESTINGOFNEWDRUGSUBSTANCESANDPRODUCTS1.INTRODUCTION1.1.ObjectivesoftheGuidelineThefollowingguidelineisarevisedversionoftheICHQ1AguidelineanddefinesthestabilitydatapackageforanewdrugsubstanceordrugproductthatissufficientforaregistrationapplicationwithinthethreeregionsoftheEC,Japan,andtheUnitedStates.Itdoesnotseeknecessarilytocoverthetestingforregistrationinorexporttootherareasoftheworld.Theguidelineseekstoexemplifythecorestabilitydatapackagefornewdrugsubstancesandproducts,butleavessufficientflexibilitytoencompassthevarietyofdifferentpracticalsituationsthatmaybeencounteredduetospecificscientificconsiderationsandcharacteristicsofthematerialsbeingevaluated.Alternativeapproachescanbeusedwhentherearescientificallyjustifiablereasons.1.2.ScopeoftheGuidelineTheguidelineaddressestheinformationtobesubmittedinregistrationapplicationsfornewmolecularentitiesandassociateddrugproducts.Thisguidelinedoesnotcurrentlyseektocovertheinformationtobesubmittedforabbreviatedorabridgedapplications,variations,clinicaltrialapplications,etc.Specificdetailsofthesamplingandtestingforparticulardosageformsintheirproposedcontainerclosuresarenotcoveredinthisguideline.新原料药和制剂稳定性试验1.导言1.1.目的下述的指导原则是ICHQ1A的修订版本,并且它为新原料药和制剂在欧洲、日本、美国三个地区注册所需要的稳定性资料做出规定要求。它并不涵盖世界其它地区或出口到这些地区的注册要求。本指导原则试图去例证新原料药和制剂的核心稳定性数据,但是留有足够的弹性空间去适应由于特殊的科学考虑和被评估物质特殊性质而导致的各种不同的具体情况。在有科学依据和理由的情况下也可以采用替代的方案。1.2.范围本指导文件所针对的是新分子实体及其相关制剂注册时需提交的信息。此指导文件并不寻...