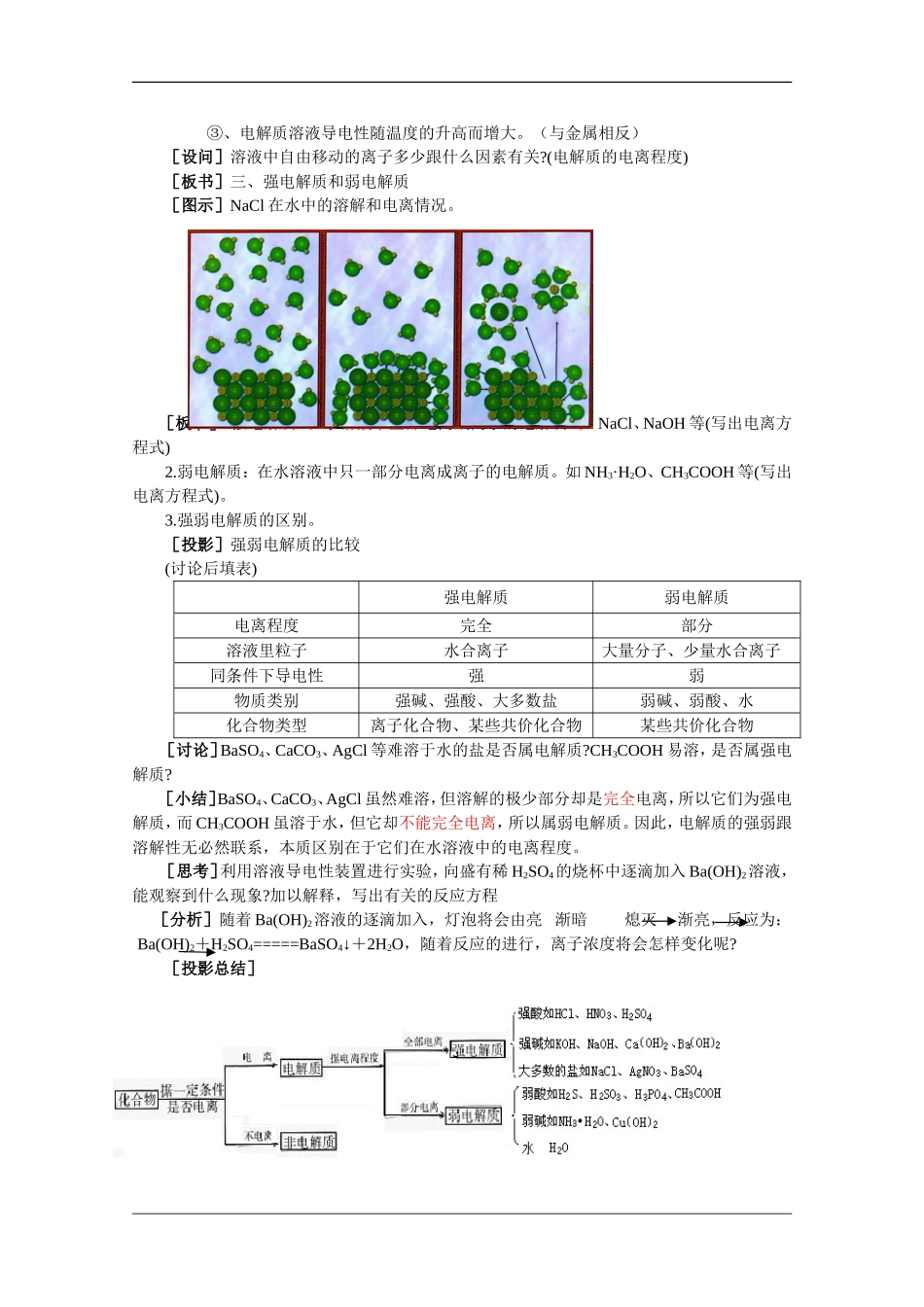
第二节离子反应●教学目标1.使学生了解电解质、强电解质和弱电解质的概念。2.使学生理解离子反应和离子方程式的含义。3.使学生理解离子反应发生的条件和离子方程式的书写方法。4.培养学生通过实验探究问题、分析问题、归纳问题的能力。●教学重点电解质、强弱电解质、离子反应和离子反应方程式的书写。●教学难点离子反应方程式的书写方法。●课时安排共3课时●教学方法实验、讨论、设疑、讲解等。●教学准备电解质溶液导电性实验的仪器和装置。试管、胶头滴管、烧杯、量筒、铁架台、漏斗、玻璃棒、滤纸。0.1mol·L-1的HCl、NaOH、NaCl、NH3·H2O、CH3COOH溶液。1mol·L-1的BaCl2溶液、CuSO4溶液、AgNO3溶液、稀HNO3。●教学过程第二节离子反应(第一课时)[引入]回顾化学反应的分类知识。[投影][小结]化学反应从不同的角度可以有不同的分法,今天我们学习离子反应。[板书]一、电离1、定义:电解质溶于水或受热熔化时,解离成自由离子的过程叫电离[提问]下列物质中哪些能导电?为什么能导电?盐酸、NaOH溶液、NaCl固体、石墨、蔗糖溶液、酒精溶液、K2SO4溶液、Cu。[小结]①石墨、铜能导电,因为其中有自由移动的电子存在。②盐酸、NaOH溶液、K2SO4溶液能导电,因为它们的溶液中有自由移动的离子存在。[追问]在盐酸、NaOH溶液、K2SO4溶液里的自由移动的离子是怎样产生的?可通过什么方法证明溶液中存在离子?[小结]①可通过溶液导电性来检验。②电离产生(电解质溶于水或受热熔化时,解离成自由离子的过程叫电离),其过程可用电离方程式来表示。[板书]2、电离方程式[练习]书写下列物质的电离方程式:HCl、KCl、H2SO4、Na2SO4、AgNO3、BaCl2、NaHSO4、NaHCO3[板演]HCl==H++Cl-KCl==K++Cl-H2SO4==2H++SO42-Na2SO4==2Na++SO42-AgNO3==Ag++NO3-BaCl2==Ba2++2Cl-NaHSO4==Na++H++SO42-NaHCO3==Na++HCO3-[强调]HCO3-、OH-、SO42-等原子团不能拆开。[过渡]我们把HCl、KCl、H2SO4、Na2SO4、AgNO3、BaCl2、NaOH称为电解质。我们把蔗糖称为非电解质。那什摸是电解质,什摸又是非电解质?[板书]二、电解质和非电解质1、定义:电解质:在水溶液里或熔化状态下能够导电的化合物,如酸、碱、盐、部分金属氧化物等。非电解质:在水溶液里和熔化状态下都不导电的化合物,如蔗糖、酒精等。[讲解]电解质、非电解质是根据物质在一定条件下能否导电对化合物的一种分类。[讨论]下列物质中哪些是电解质?Cu、NaCl固体、NaOH固体、K2SO4溶液、CO2、蔗糖、NaCl溶液、H2O、酒精。[小结]应注意以下几点:①电解质应是化合物(属于纯净物)。而Cu则是单质(能导电的物质不一定是电解质,如石墨或金属),K2SO4与NaCl溶液都是混合物。②电解质应是一定条件下本身电离而导电的化合物。而CO2能导电是因CO2与H2O反应生成了H2CO3,H2CO3能够电离而非CO2本身电离。所以CO2不是电解质,是非电解质(如氨气、二氧化硫、三氧化硫)。③酸、碱、盐、水是电解质,蔗糖、酒精为非电解质。[设问]相同条件下,不同种类的酸、碱、盐溶液的导电能力是否相同?[演示实验1—1]观察:五种电解质溶液的导电性是否相同?并分析结果。(结果:相同条件下,不同种类的酸、碱、盐溶液的导电能力不相同)[讲述]电解质溶液之所以能够导电是因为有自由移动的离子存在,而电解质溶液导电能力的大小决定于溶液中自由移动的离子的浓度以及离子所带电荷数。导电能力强的溶液里的自由移动的离子浓度一定比导电能力弱的溶液里的自由移动的离子浓度大。比较以上五种溶液,显然,在等体积时CH3COOH、NH3·H2O溶液中的自由移动离子数目较少,即离子浓度较小。[板书]2、电解质溶液导电情况:①、解质溶液导电能力的大小决定于溶液中自由移动的离子的浓度的大小,与电解质本身强弱无关。②、电解质离子所带电荷数越多,导电性越强。(如同温同浓度MgSO4>NaCl)③、电解质溶液导电性随温度的升高而增大。(与金属相反)[设问]溶液中自由移动的离子多少跟什么因素有关?(电解质的电离程度)[板书]三、强电解质和弱电解质[图示]NaCl在水中的溶解和电离情况。[板书]1.强电解质:在水溶液中全部电离成离子的电解质。如NaCl、...