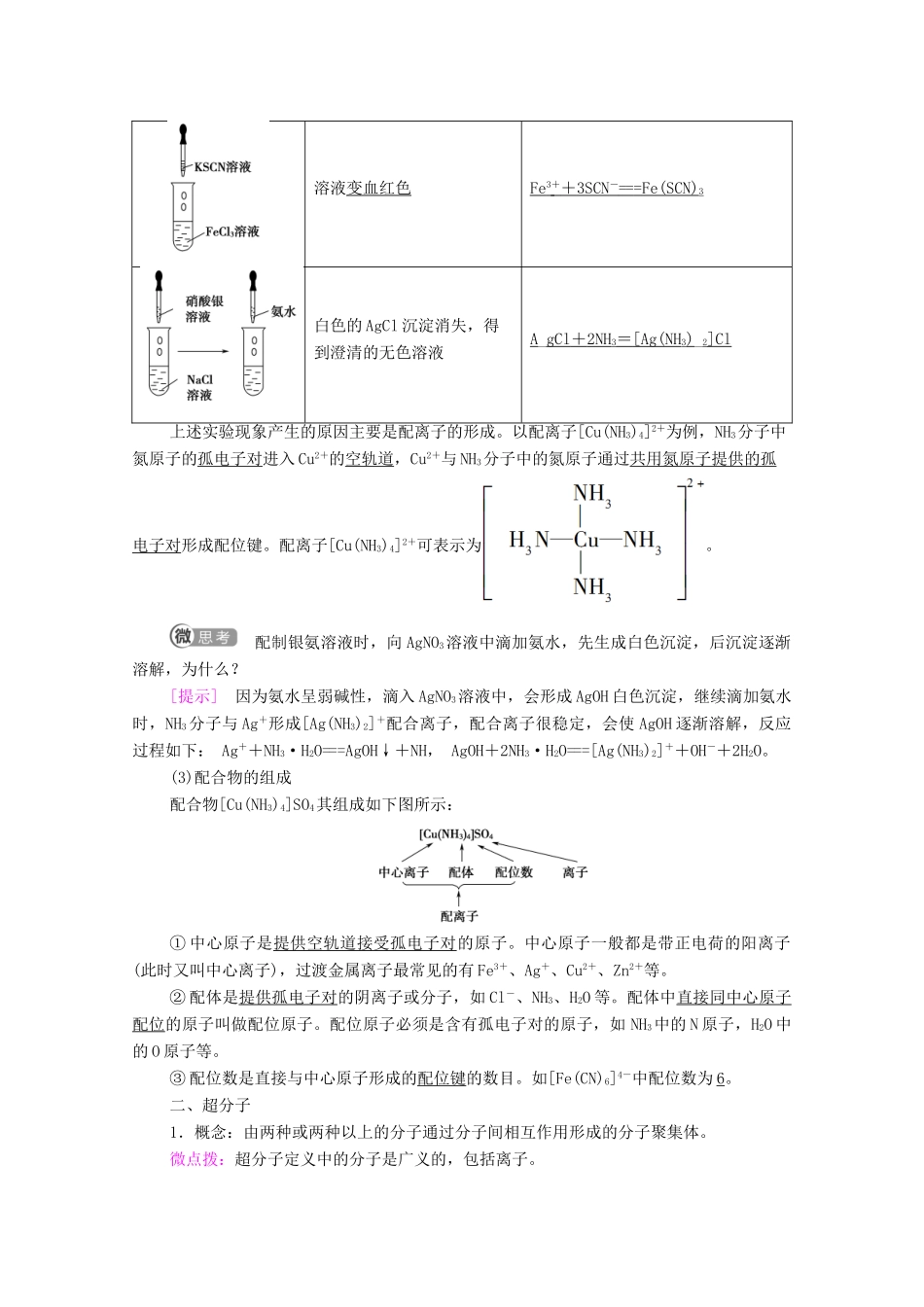
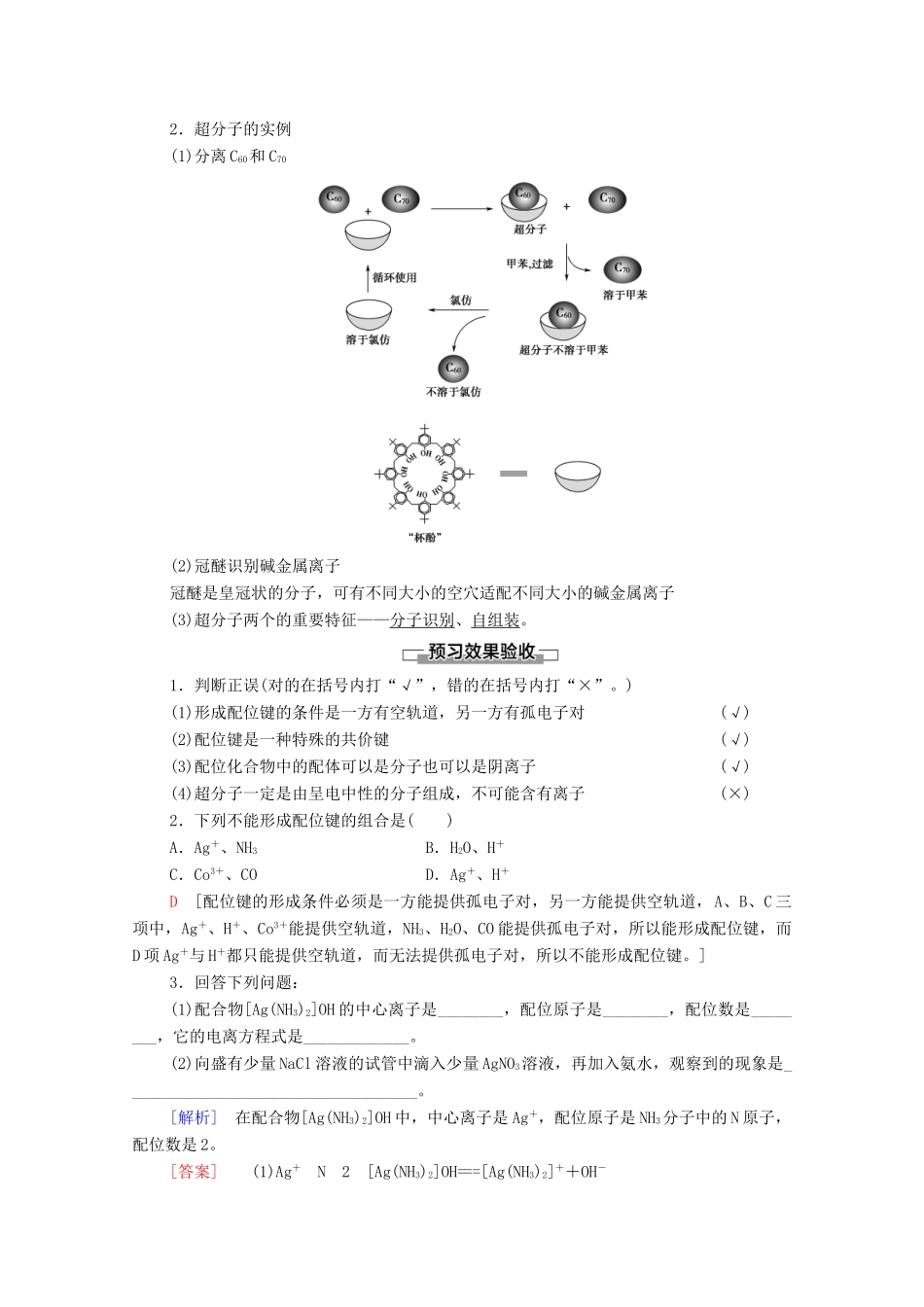
第四节配合物与超分子发展目标体系构建1.能从微观角度理解配位键的形成条件和表示方法;能判断常见的配合物。2.能利用配合物的性质去推测配合物的组成,从而形成“结构决定性质”的认知模型。3.了解超分子概念及其特性。一、配合物1.配位键(1)概念:成键原子一方提供孤电子对,另一方提供空轨道形成的共价键。微点拨:配位键是一种特殊的共价键。配位键中的共用电子对是由成键单方提供的,而其他的共价键的共用电子对是由成键双方提供的。(2)配位键的形成条件①成键原子一方能提供孤电子对。如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等。②成键原子另一方能提供空轨道。如H+、Al3+、B及过渡金属的原子或离子。(3)配位键同样具有饱和性和方向性。一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。2.配位化合物(1)配合物的概念:把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。如[Cu(NH3)4]SO4、[Ag(NH3)2]OH、NH4Cl等均为配合物。(2)配合物的形成实验操作实验现象有关离子方程式滴加氨水后,试管中首先出现蓝色沉淀,氨水过量后沉淀逐渐溶解,滴加乙醇后析出深蓝色晶体[Cu(NH3)4]SO4·H2OCu2++2NH3·H2O===Cu(OH)2↓+2NH、Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-溶液变血红色Fe3++3SCN-===Fe(SCN)3白色的AgCl沉淀消失,得到澄清的无色溶液A_gCl+2NH3=[Ag(NH3)_2]Cl上述实验现象产生的原因主要是配离子的形成。以配离子[Cu(NH3)4]2+为例,NH3分子中氮原子的孤电子对进入Cu2+的空轨道,Cu2+与NH3分子中的氮原子通过共用氮原子提供的孤电子对形成配位键。配离子[Cu(NH3)4]2+可表示为。配制银氨溶液时,向AgNO3溶液中滴加氨水,先生成白色沉淀,后沉淀逐渐溶解,为什么?[提示]因为氨水呈弱碱性,滴入AgNO3溶液中,会形成AgOH白色沉淀,继续滴加氨水时,NH3分子与Ag+形成[Ag(NH3)2]+配合离子,配合离子很稳定,会使AgOH逐渐溶解,反应过程如下:Ag++NH3·H2O===AgOH↓+NH,AgOH+2NH3·H2O===[Ag(NH3)2]++OH-+2H2O。(3)配合物的组成配合物[Cu(NH3)4]SO4其组成如下图所示:①中心原子是提供空轨道接受孤电子对的原子。中心原子一般都是带正电荷的阳离子(此时又叫中心离子),过渡金属离子最常见的有Fe3+、Ag+、Cu2+、Zn2+等。②配体是提供孤电子对的阴离子或分子,如Cl-、NH3、H2O等。配体中直接同中心原子配位的原子叫做配位原子。配位原子必须是含有孤电子对的原子,如NH3中的N原子,H2O中的O原子等。③配位数是直接与中心原子形成的配位键的数目。如[Fe(CN)6]4-中配位数为6。二、超分子1.概念:由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。微点拨:超分子定义中的分子是广义的,包括离子。2.超分子的实例(1)分离C60和C70(2)冠醚识别碱金属离子冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子(3)超分子两个的重要特征——分子识别、自组装。1.判断正误(对的在括号内打“√”,错的在括号内打“×”。)(1)形成配位键的条件是一方有空轨道,另一方有孤电子对(√)(2)配位键是一种特殊的共价键(√)(3)配位化合物中的配体可以是分子也可以是阴离子(√)(4)超分子一定是由呈电中性的分子组成,不可能含有离子(×)2.下列不能形成配位键的组合是()A.Ag+、NH3B.H2O、H+C.Co3+、COD.Ag+、H+D[配位键的形成条件必须是一方能提供孤电子对,另一方能提供空轨道,A、B、C三项中,Ag+、H+、Co3+能提供空轨道,NH3、H2O、CO能提供孤电子对,所以能形成配位键,而D项Ag+与H+都只能提供空轨道,而无法提供孤电子对,所以不能形成配位键。]3.回答下列问题:(1)配合物[Ag(NH3)2]OH的中心离子是________,配位原子是________,配位数是________,它的电离方程式是_____________。(2)向盛有少量NaCl溶液的试管中滴入少量AgNO3溶液,再加入氨水,观察到的现象是____________________________________。[解析]在配合物[Ag(NH3)2]OH中,中心离子是Ag+,配位原...