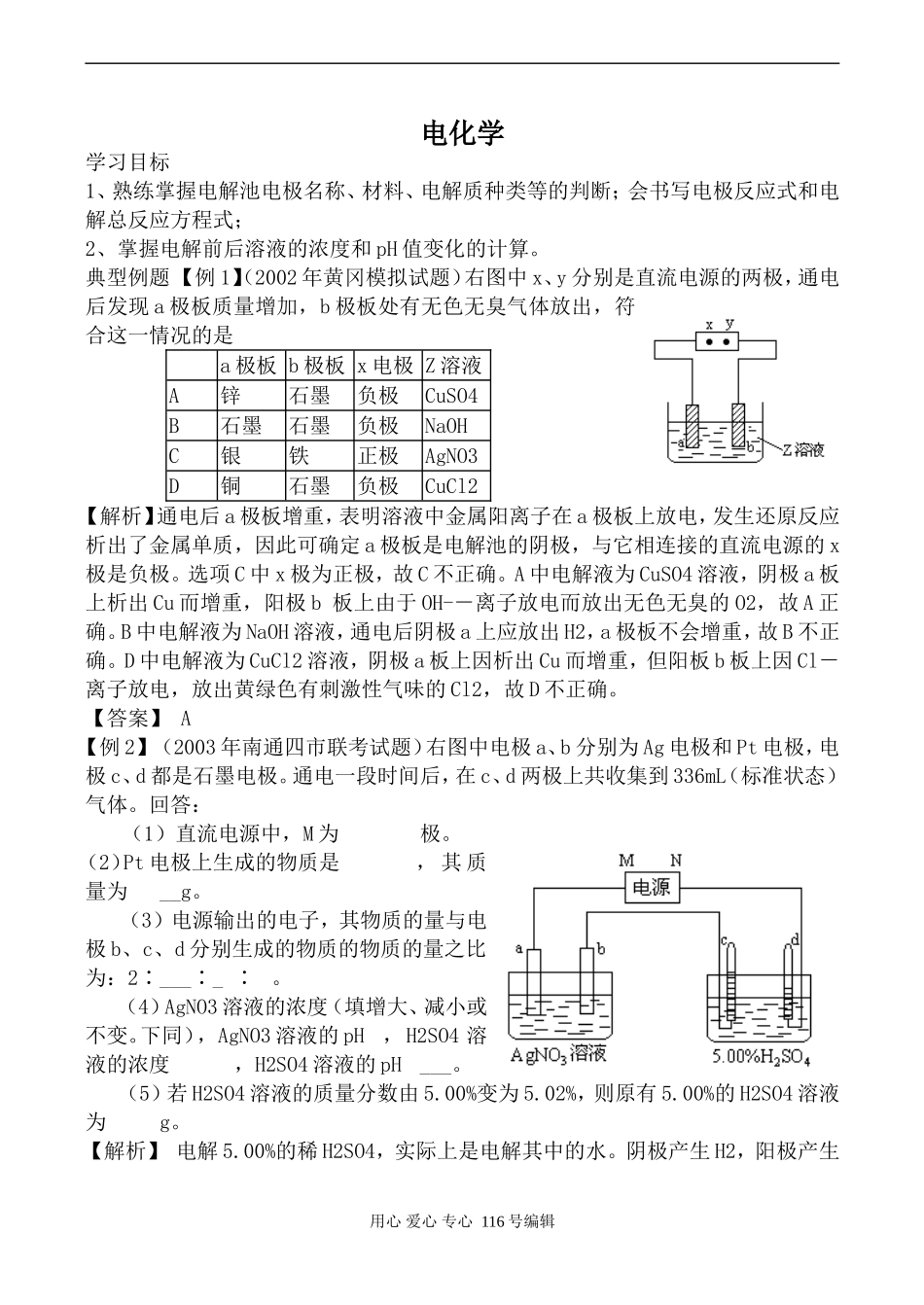
电化学学习目标1、熟练掌握电解池电极名称、材料、电解质种类等的判断;会书写电极反应式和电解总反应方程式;2、掌握电解前后溶液的浓度和pH值变化的计算。典型例题【例1】(2002年黄冈模拟试题)右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是a极板b极板x电极Z溶液A锌石墨负极CuSO4B石墨石墨负极NaOHC银铁正极AgNO3D铜石墨负极CuCl2【解析】通电后a极板增重,表明溶液中金属阳离子在a极板上放电,发生还原反应析出了金属单质,因此可确定a极板是电解池的阴极,与它相连接的直流电源的x极是负极。选项C中x极为正极,故C不正确。A中电解液为CuSO4溶液,阴极a板上析出Cu而增重,阳极b板上由于OH--离子放电而放出无色无臭的O2,故A正确。B中电解液为NaOH溶液,通电后阴极a上应放出H2,a极板不会增重,故B不正确。D中电解液为CuCl2溶液,阴极a板上因析出Cu而增重,但阳板b板上因Cl-离子放电,放出黄绿色有刺激性气味的Cl2,故D不正确。【答案】A【例2】(2003年南通四市联考试题)右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答:(1)直流电源中,M为极。(2)Pt电极上生成的物质是,其质量为__g。(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2∶___∶_∶。(4)AgNO3溶液的浓度(填增大、减小或不变。下同),AgNO3溶液的pH,H2SO4溶液的浓度,H2SO4溶液的pH___。(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为g。【解析】电解5.00%的稀H2SO4,实际上是电解其中的水。阴极产生H2,阳极产生用心爱心专心116号编辑O2,且V(H2)∶V(O2)=2∶1,据此可确定d极为阴极,则电源的N极为负极,V(H2)=336mL×2/3=224mL,即为0.01mol,V(O2)=336mL×1/3=112mL,即为0.005mol。说明电路上有0.02mol电子,因此在b极(Pt、阴极)产生,即0.02mol的Ag。则n(e)∶n(Ag)∶n(O2)∶n(H2)=0.02∶0.02∶0.005∶0.01=2∶2∶∶1;由Ag(阳)电极、Pt(阴)电极和AgNO3溶液组成的电镀池,因此AgNO3溶液浓度不变,pH也不变。电解5.00%的H2SO4溶液,由于其中的水发生电解,因此H2SO4溶液浓度增大,pH减小。设原5.00%的H2SO4溶液为xg,电解时消耗水0.01×18=0.18g,则:,解得:。【答案】(1)正;(2)Ag、2.16;(3)2∶∶1;(4)不变、不变、增大、减小;(5)45.18。课堂练习1、下列关于铜电极的叙述正确的是:(AC)A.铜锌原电池中铜是正极B.用电解法精炼粗铜时粗铜作阴极C.在镀件上电镀铜时可用金属铜作阳极D.电解稀硫酸制H2、O2时铜作阳极2、实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:负极:;正极:今若制得Cl20.050mol,这时电池内消耗的H2SO4的物质的量至少是:(C)A.0.025molB.0.050molC.0.10molD.0.20mol3、有一硝酸盐晶体,其化学式表示为M(NO3)x·nH2O经测定其摩尔质量为242g·mol-1。取1.21g该晶体溶于水配成100mL溶液。将此溶液倒入右图所示装置中,用石墨作电极进行电解。当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32g。回答:(1)金属M的原子量为,x=,n=。(2)C极为极。(3)电解后溶液的pH为(设电解前后溶液的体积不变)。【答案】(1)64、2、3;(2)负;(3)1。4、从H+、Cu2+、Na+、Cl-、SO42—五种离子中恰当地组成电解质,按下列要求进行电解:(1)以碳棒为电极,使电解质质量减少,水质量不变,进行电解,则可采用的电解质是___________________。(2)以碳棒为电极,使电解质质量不变,水质量减少,进行电解,则可采用的电解质是______________________。用心爱心专心116号编辑(3)以碳棒为阳极,铁棒为阴极,使电解质被电解可能的物质是HCl、CuCl2。根据两种阴离子和三种阳离子,组合成六种物再根据电解知识就可以迅速作答。【答案】(1)HCl、CuCl2;(2)H2SO4、Na2SO4;(3)NaCl、CuSO4和H2SO4混合溶液。用心爱心专心116号编辑