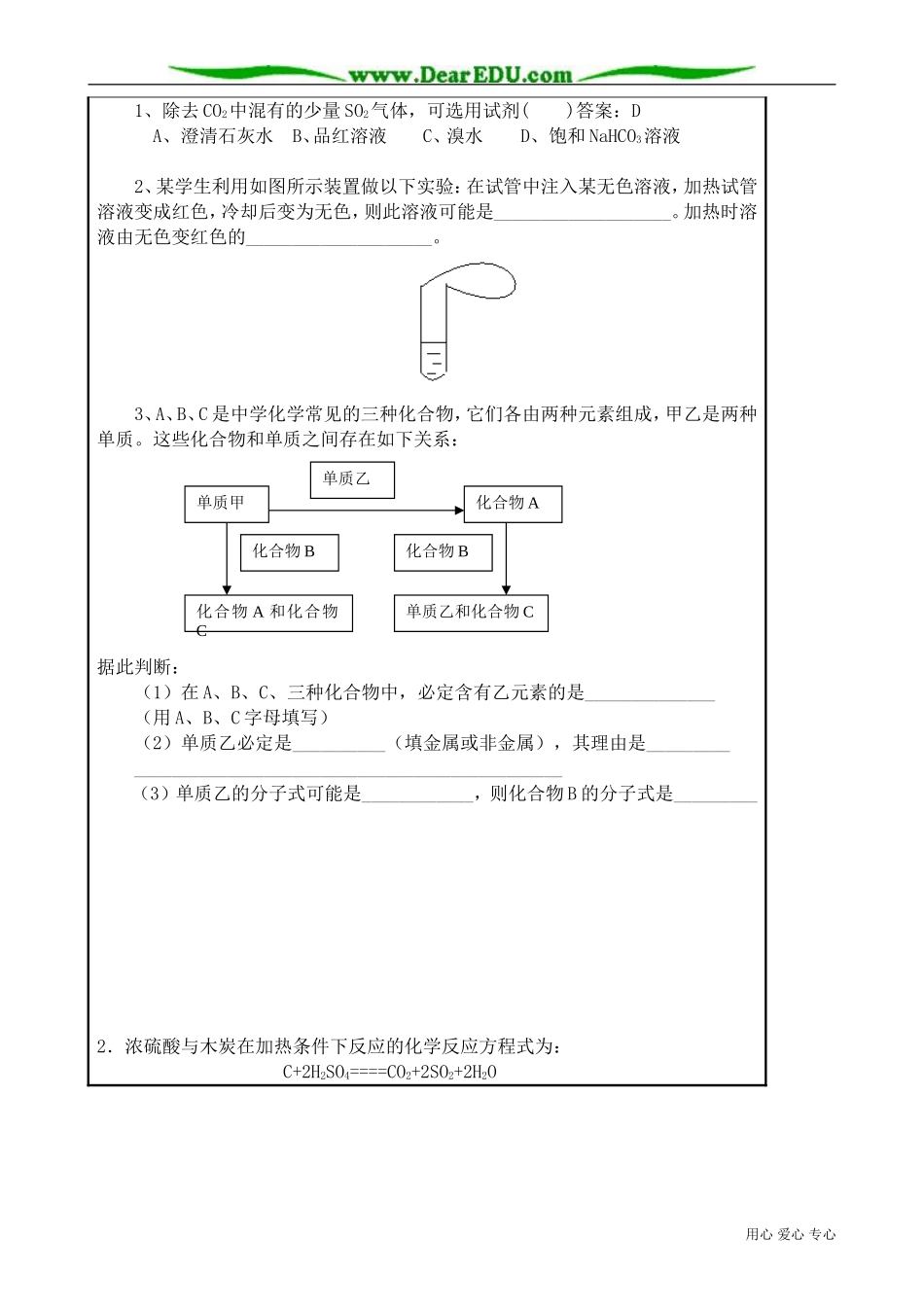
教学课题及内容二氧化硫(2)第教时(累计第教时)授课时间年月日目的要求1、了解二氧化硫的物理性质和用途。2、掌握二氧化硫的化学性质。3、了解二氧化硫对空气的污染和防止污染重点难点二氧化硫的化学性质课后小结教学过程:1、具有酸性氧化物的通性思考1:SO2通入BaCl2溶液中有现象吗?2、弱氧化性:2H2S+SO2=3S↓+2H2O3、还原性2SO2+O22SO35SO2+2H2O+2KMnO4=2MnSO4+2MnSO4+K2SO42SO2+Cl2+2H2O==H2SO4+2HClSO2+Br2+H2O===H2SO4+2HBrSO2+I2+H2O===H2SO4+2HI4、漂白性思考2:CO2和SO2在化学性质上既有相似性又有差异性,如何区分这两种气体呢?[回答]可将两种气体分别通过品红溶液或溴水或KMnO4溶液,使之褪色者为SO2,反之为CO2。用心爱心专心V2O5500℃[追问]能用澄清石灰水鉴别吗?为什么?[回答]不能。因两者均能使澄清石灰水先变浑浊,后又变澄清。原理为:CO2+Ca(OH)2==CaCO3↓+H2OCaCO3+H2O+CO2==Ca(HCO3)2SO2+Ca(OH)2==CaSO3↓+H2OCaSO3+H2O+SO2==Ca(HSO3)2[讲述]我们知道性质决定用途,SO2的性质决定了它具有什么样的用途呢?[阅读]SO2的用途。[提问]SO2具有什么样的用途?小结、SO2的主要用途(1)制硫酸:SSO2SO3H2SO4思考3:H2SSO2SO3CCOCO2NaNa2ONa2O2(2)漂白纸浆、毛、丝、草帽等(3)杀菌消毒三、SO2的制备Na2SO3(固)+H2SO4(浓)(70%~80%)=Na2SO4+H2O+SO2↑干燥:浓H2SO4[过渡]SO2有它的用途,但事物都是两面的,有利也有弊。二氧化硫也不例外。[板书]四、SO2的污染1、大气中二氧化硫的主要来源:2、二氧化硫的危害:3、酸雨的概念、成因、危害:小结酸雨的形成:H2OO2(1)SO2H2SO3H2SO4(主要途径)灰尘H2O(2)SO2SO3H2SO4讨论:收集酸雨测定其pH,一断时间内PH随时间推移而下降,为什么?往亚硫酸钡沉淀中滴加强氧化性的硝酸,沉淀能溶解吗?[知识拓展]五、亚硫酸和亚硫酸盐1、亚硫酸:二元中强酸,不稳定,强还原性。2、亚硫酸盐:Na2SO3、BaSO3强还原性。2Na2SO3+O2=2Na2SO4亚硫酸盐在空气中极易被氧化,应密封保存。六、SO31、物性:无色,易挥发的晶体,熔点16.8℃,沸点44.8℃2、化性:具有酸的通性:SO3+H2O=H2SO4(剧烈反应,同时放出大量的热)2NaHSO3+SO3=Na2SO4+2SO2↑+H2O具有强氧化性:5SO3+2P=P2O5+5SO2练习:用心爱心专心1、除去CO2中混有的少量SO2气体,可选用试剂()答案:DA、澄清石灰水B、品红溶液C、溴水D、饱和NaHCO3溶液2、某学生利用如图所示装置做以下实验:在试管中注入某无色溶液,加热试管溶液变成红色,冷却后变为无色,则此溶液可能是___________________。加热时溶液由无色变红色的____________________。3、A、B、C是中学化学常见的三种化合物,它们各由两种元素组成,甲乙是两种单质。这些化合物和单质之间存在如下关系:据此判断:(1)在A、B、C、三种化合物中,必定含有乙元素的是______________(用A、B、C字母填写)(2)单质乙必定是__________(填金属或非金属),其理由是_______________________________________________________(3)单质乙的分子式可能是____________,则化合物B的分子式是_________2.浓硫酸与木炭在加热条件下反应的化学反应方程式为:C+2H2SO4====CO2+2SO2+2H2O用心爱心专心单质乙和化合物C化合物A和化合物C单质甲单质乙化合物A化合物B化合物B(1)试用下图所示装置设计一个实验,来检验上述反应所产生的各种产物。这些装置的连接顺序是(填装置的编号)(2)实验时可观察到装置①中A瓶溶液褪色,C瓶溶液不褪色。A瓶溶液的作用是_______________B瓶溶液的作用是_____________________C瓶溶液的作用是__________________。(3)装置②中所加固体药品是__________,可验证的产物__________,确定装置在整套装置中位置的理由是_____________________。(4)装置③中所盛的溶液是______________,可验证的产物是___________用心爱心专心