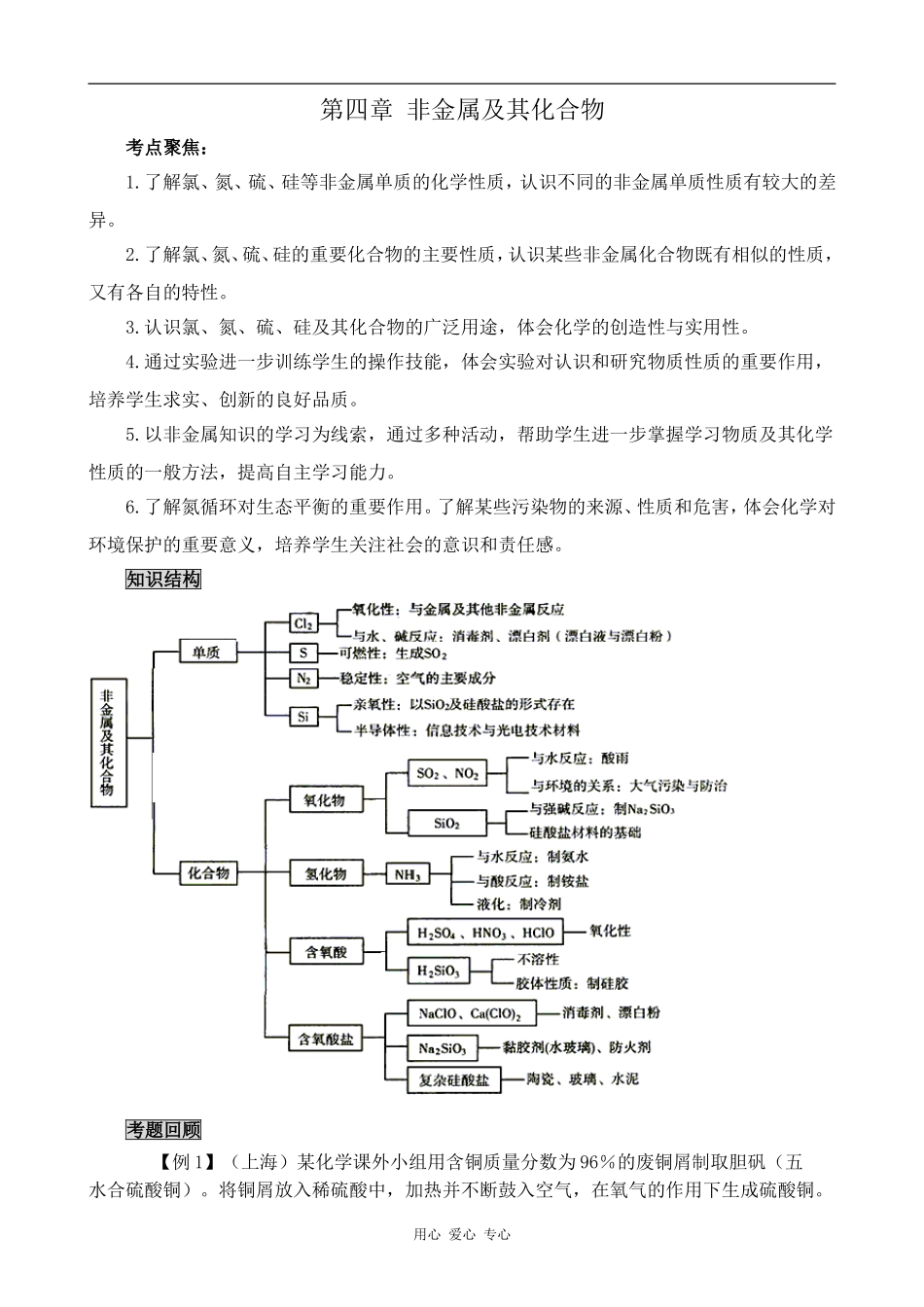
第四章非金属及其化合物考点聚焦:1.了解氯、氮、硫、硅等非金属单质的化学性质,认识不同的非金属单质性质有较大的差异。2.了解氯、氮、硫、硅的重要化合物的主要性质,认识某些非金属化合物既有相似的性质,又有各自的特性。3.认识氯、氮、硫、硅及其化合物的广泛用途,体会化学的创造性与实用性。4.通过实验进一步训练学生的操作技能,体会实验对认识和研究物质性质的重要作用,培养学生求实、创新的良好品质。5.以非金属知识的学习为线索,通过多种活动,帮助学生进一步掌握学习物质及其化学性质的一般方法,提高自主学习能力。6.了解氮循环对生态平衡的重要作用。了解某些污染物的来源、性质和危害,体会化学对环境保护的重要意义,培养学生关注社会的意识和责任感。知识结构考题回顾【例1】(上海)某化学课外小组用含铜质量分数为96%的废铜屑制取胆矾(五水合硫酸铜)。将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气的作用下生成硫酸铜。用心爱心专心(1)写出生成硫酸铜的化学方程式:_________________________;(2)现用1kg这种废铜屑理论上能制取胆矾多少克?_________________________。(3)将胆矾与生石灰、水按质量比为1∶0.56∶100混合配制成无机铜杀菌剂波尔多液。①此波尔多液中2Cu和2Ca的物质的量比为_____________(最简整数比)。②波尔多液有效成分的化学式可表示为:224)OH(yCa)OH(xCuCuSO,当x=1时,试确定y的数值。解析:(1)稀硫酸不具有强氧化性,不能氧化不活泼金属铜,但是铜容易被氧气氧化生成CuO,CuO能与酸反应生成盐和水。OH2CuSO2OSOH2Cu224242。(2)根据质量守恒定律进行计算:kg75.3molg250molg6496.0kg111(3)①根据元素守恒,波尔多液中的2Cu与2Ca的物质的量之比就等于胆矾和生石灰的物质的量之比,即5∶2)Ca(n∶)Cu(n22。②4224CaSO)OH(Cu)OH(CaCuSO反应前2500反应前1411所以224)OH(yCa)OH(CuCuSO中y=4。【例2】(广东高考24)、向300mLKOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。请回答下列问题:(1)由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,并分别列出。(2)若通入CO2气体为2.24L(标准状况下),得到11.9g的白色固体。请通过计算确定此白色固体是由哪些物质组成的,其质量各为多少?所用的KOH溶液的物质的量浓度为多少?解析:本题涉及的反应有:CO2+2KOH=K2CO3+H2OCO2+KOH=KHCO3,由方程式可知,反应分四个阶段进行:①CO2通入量较少时主要得到K2CO3并有过量的KOH;②当KOH恰巧完全反应,只存在生成物K2CO3;③继续通入CO2时,开始有KHCO3生成;④通入的CO2使K2CO3全部转化成KHCO3。所以是(1)有四种组合,分别是:K2CO3+KOH②K2CO3③K2CO3+KHCO3④KHCO3;(2)22.4L(标态)CO2→0.1molCO2;且M(K2CO3)=138g/mol;M(KHCO3)=100g/mol由碳元素守恒可知:0.1molCO2既能生成0.1的K2CO3;也可生成0.1的KHCO3,设0.1molCO2所产生的K2CO3为xmol,则有:138x+100(0.1-x)=11.9;x=0.05molm(K2CO3)==138g/mol0.05mol==6.9g用心爱心专心m(KHCO3)==100g/mol0.05mol==5.0g由K2CO3、KHCO3中K元素守恒可知:KOH为0.15mol则有:C(KOH)=【例3】(上海高考31)、硫铁矿高温下空气氧化产生二氧化硫:4FeS2+11O2→8SO2+2Fe2O3,设空气中N2、O2的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:(1)1.00molFeS2完全氧化,需要空气的体积(标准状况)为L(2)55L空气和足量FeS2完全反应后,气体体积(同温同压)变为L(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。(4)设FeS2氧化产生的气体混合物为100L,其中O2为aL,SO2为bL。①写出a和b的关系式②在右图中画出a和b的关系曲线(FeS2氧化时,空气过量20%)说明:为方便作图,纵坐标用13b表示解析:(1)4FeS2→11O24111molmol所需O2体积为:(2)11O2→8SO2118Lyy=生成的气体体积为:(3)设SO2为X(体积分数),用心爱心专心11O2→8SO2118xO2的总体积为:(+0.0800);N2的总体积为:(+0.0800);若混合气体的总体积为1,则N2的总体积也可表示为:1-0.0800-X所以有:4×(11×X/8+0.0800)=1-0.0800-X,X=0.0923(4)①FeS2氧化产生的气体混合物为100L,其中O2为aL,SO2为bL,则反应的O2为,N2为4()L,固有:4()+a+b=100解之得:13b=200-10a②由一次函数列表为:横坐标(a)L20103纵坐标13b0100170用心爱心专心