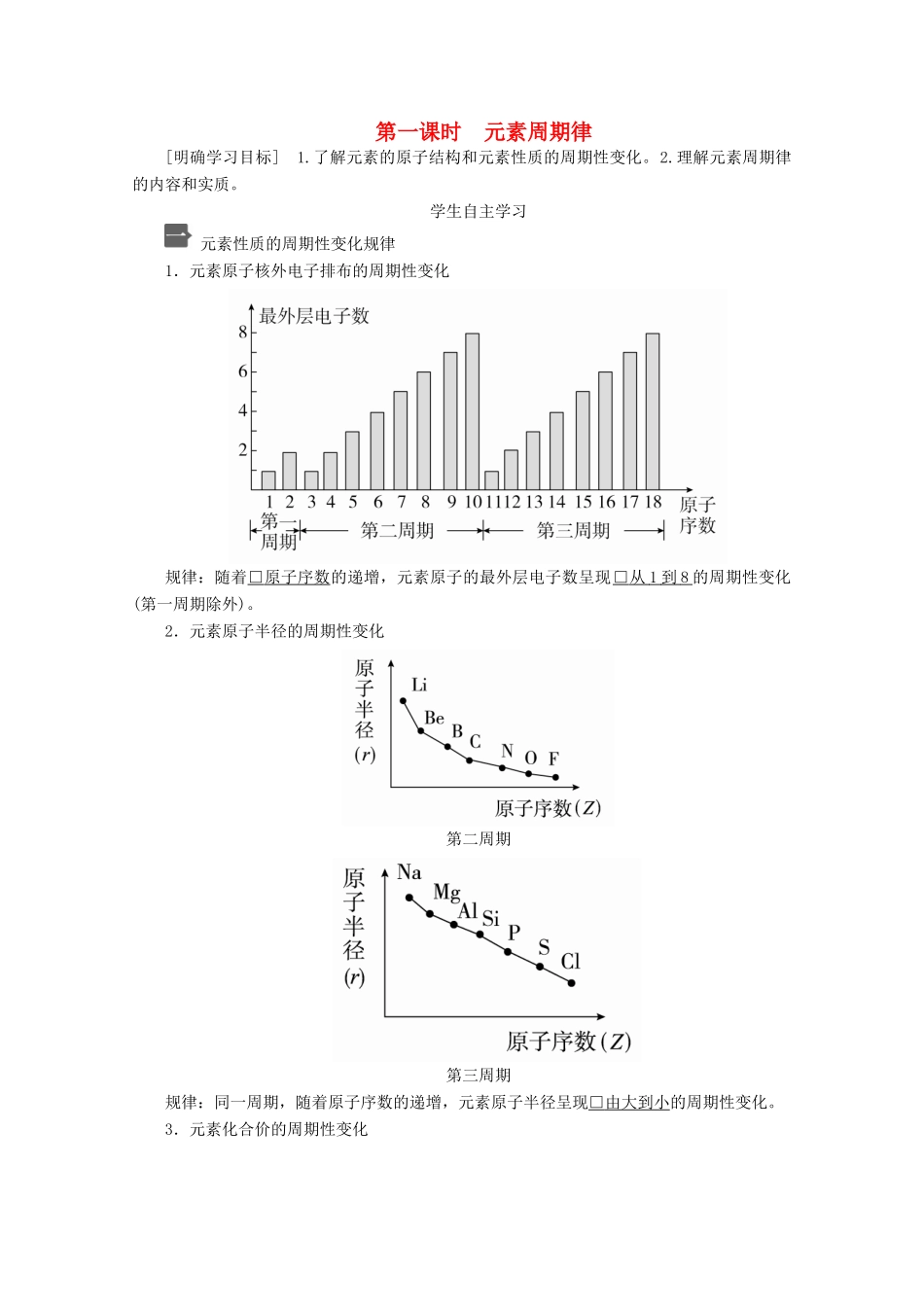
第一课时元素周期律[明确学习目标]1.了解元素的原子结构和元素性质的周期性变化。2.理解元素周期律的内容和实质。学生自主学习元素性质的周期性变化规律1.元素原子核外电子排布的周期性变化规律:随着□原子序数的递增,元素原子的最外层电子数呈现□从1到8的周期性变化(第一周期除外)。2.元素原子半径的周期性变化第二周期第三周期规律:同一周期,随着原子序数的递增,元素原子半径呈现□由大到小的周期性变化。3.元素化合价的周期性变化规律:随着原子序数的递增,元素的化合价呈□周期性变化[每周期:最高正价:□+1→□+7(第二周期为□+5),负价:□-4→□-1(稀有气体元素除外)]。第三周期元素性质的递变1.钠、镁、铝金属性强弱比较(1)钠、镁、铝置换出水(或酸)中的氢时,由易到难的顺序是□Na>Mg>Al。(2)钠、镁、铝的最高价氧化物对应的水化物的碱性由强到弱的顺序为□NaOH>Mg(OH)2>Al(OH)3。(3)钠、镁、铝的金属性由强到弱的顺序为□Na>Mg>Al。2.硅、磷、硫、氯非金属性强弱比较(1)硅、磷、硫、氯单质与氢气化合时条件由易到难的顺序为□Cl2>S>P>Si。(2)硅、磷、硫、氯最高价氧化物对应水化物的酸性由强到弱的顺序为□HClO4>H2SO4>H3PO4>H2SiO3。(3)硅、磷、硫、氯元素非金属性由强到弱的顺序为□Cl>S>P>Si。3.同周期元素性质递变规律元素周期律1.内容元素的性质随着原子序数的递增而□呈周期性的变化。2.实质元素性质的周期性变化是元素原子的□核外电子排布周期性变化的必然结果。1.C、N、O、F的最高正价是否依次增大?提示:否,O、F均无正价。2.非金属元素的最高正价与最低负价有什么关系?提示:非金属元素的最高正价与最低负价的绝对值之和等于8(H、B、O、F除外)。3.如何通过实验证明H3PO4的酸性强于H2SiO3?提示:向Na2SiO3溶液中加入H3PO4溶液,产生白色浑浊,则证明H3PO4的酸性强于H2SiO3。4.试根据同周期元素非金属性的变化规律,比较SiH4、PH3、H2S和HCl的稳定性。提示:元素的非金属性越强,气态氢化物越稳定。同周期元素,随着原子序数的递增,非金属性逐渐增强,故非金属性:Si
r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)。2.同主族——“序大径大”(1)规律:同主族,从上到下,原子(或离子)半径逐渐增大。(2)举例:碱金属:r(Li)r(Cl)。(2)同种元素不同价态的阳离子半径比较规律——“数大径小”。带电荷数越多,粒子半径越小。如:r(Fe3+)r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。1下列粒子半径大小比较正确的是()A.Na+Cl->Na+>Al3+C.Nar(Rb)>r(K)>r(Na),D错误;S2-和Cl-核外电子数相同,但核电荷数Cl>S,故离子半径r(S2-)>r(Cl-);Na+和Al3+核外电子数相同,且核电荷...