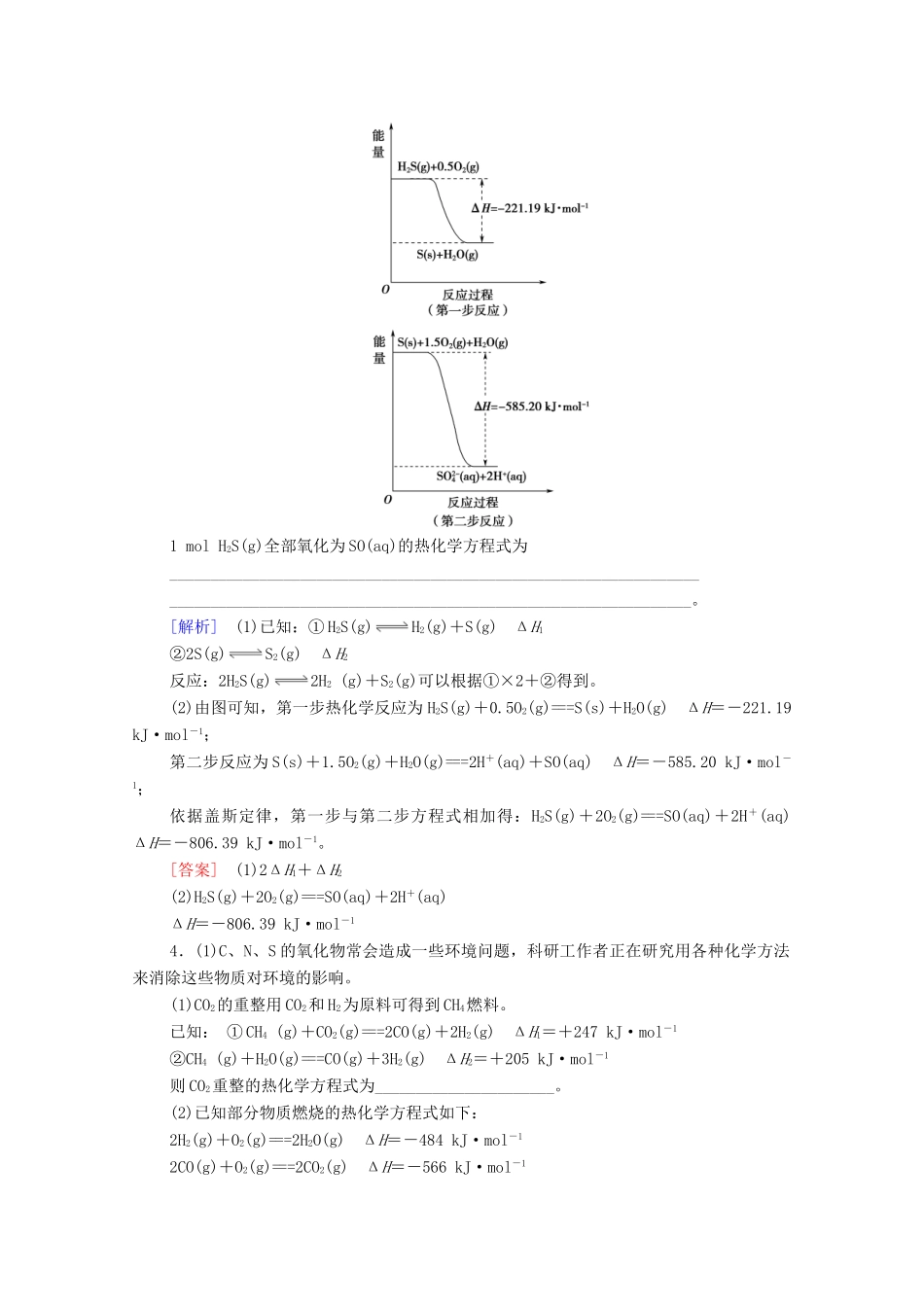
微专题1利用盖斯定律推测并书写热化学方程式[微点突破]1.运用盖斯定律的技巧——“三调一加”一调:根据目标热化学方程式,调整已知热化学方程式中反应物和生成物的左右位置,改写已知的热化学方程式。二调:根据改写的热化学方程式调整相应ΔH的符号。三调:调整中间物质的化学计量数。一加:将调整好的热化学方程式及其ΔH相加。2.运用盖斯定律的三个注意事项(1)热化学方程式乘以某一个数时,反应热的数值必须也乘上该数。(2)热化学方程式相加减时,物质之间相加减,反应热也必须相加减。(3)将一个热化学方程式颠倒时,ΔH的“+”“-”随之改变,但数值不变。【典例】已知下面在298K时的热化学方程式:2H2(g)+O2(g)===2H2O(l)ΔH=-571.6kJ·mol-1CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890.3kJ·mol-1C(s)+O2(g)===CO2(g)ΔH=-393.5kJ·mol-1根据上面的热化学方程式完成下列问题:(1)通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是________。(2)根据以上反应,则C(s)+2H2(g)===CH4(g)的焓变ΔH=____________。(3)已知H2O(l)===H2O(g)ΔH=+44.0kJ·mol-1试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:__________________。[解析](1)设H2、C、CH4的质量都为1g,完全燃烧时放出热量分别是kJ=142.9kJ、kJ=32.8kJ、kJ≈55.6kJ,最大值应为142.9kJ,所以相同质量的H2、C、CH4完全燃烧时,放出热量最多的是H2。(2)①2H2(g)+O2(g)===2H2O(l)ΔH=-571.6kJ·mol-1②CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890.3kJ·mol-1③C(s)+O2(g)===CO2(g)ΔH=-393.5kJ·mol-1根据盖斯定律①+③-②得到反应C(s)+2H2(g)===CH4(g)的焓变ΔH=-571.6kJ·mol-1+(-393.5kJ·mol-1)-(-890.3kJ·mol-1)=-74.8kJ·mol-1。(3)甲烷燃烧生成二氧化碳和水蒸气化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(g),①CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890.3kJ·mol-1②H2O(l)===H2O(g)ΔH=+44.0kJ·mol-1根据盖斯定律,①+②×2得:CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-890.3kJ·mol-1+(+44.0kJ·mol-1)×2=-802.3kJ·mol-1。[答案](1)H2(2)-74.8kJ·mol-1(3)CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-802.3kJ·mol-1。[专题对练]1.以H2合成尿素CO(NH2)2的有关热化学方程式有:①N2(g)+3H2(g)===2NH3(g)ΔH1=-92.4kJ·mol-1②NH3(g)+CO2(g)===NH2CO2NH4(s)ΔH2=-79.7kJ·mol-1③NH2CO2NH4(s)===CO(NH2)2(s)+H2O(l)ΔH3=+72.5kJ·mol-1则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为________________________________________________________________________________________________________________________。[解析]则根据盖斯定律可知①+②×2+③即得到N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为N2(g)+3H2(g)+CO2(g)===CO(NH2)2(s)+H2O(l)ΔH=-179.3kJ·mol-1。[答案]N2(g)+3H2(g)+CO2(g)===CO(NH2)2(s)+H2O(l)ΔH=-179.3kJ·mol-12.汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。已知:①2CO(g)+O2(g)2CO2(g)ΔH=-566.0kJ·mol-1②N2(g)+O2(g)2NO(g)ΔH=+180.5kJ·mol-1③2NO(g)+O2(g)2NO2(g)ΔH=-116.5kJ·mol-1回答下列问题:(1)CO的燃烧热为________。若1molN2(g)、1molO2(g)中化学键断裂时分别需要吸收946kJ、498kJ的能量,则1molNO(g)中化学键断裂时需吸收的能量为______kJ。(2)CO将NO2还原为单质的热化学方程式为________________________________________________________________________________________。[解析](1)根据燃烧热是指在25℃,101kPa时,1mol可燃物完全燃烧生成稳定的化合物时所放出的热量,根据反应①可知CO的燃烧热为=283kJ·mol-1;反应热等于反应物键能总和减去生成物键能总和,1molN2(g)、1molO2(g)中化学键断裂时分别需要吸收946kJ、498kJ的能量,根据N2(g)+O2(g)2NO(g)ΔH=+180.5kJ·mol-1可知,1molNO(g)中化学键断裂时需吸收的能量为:=631....