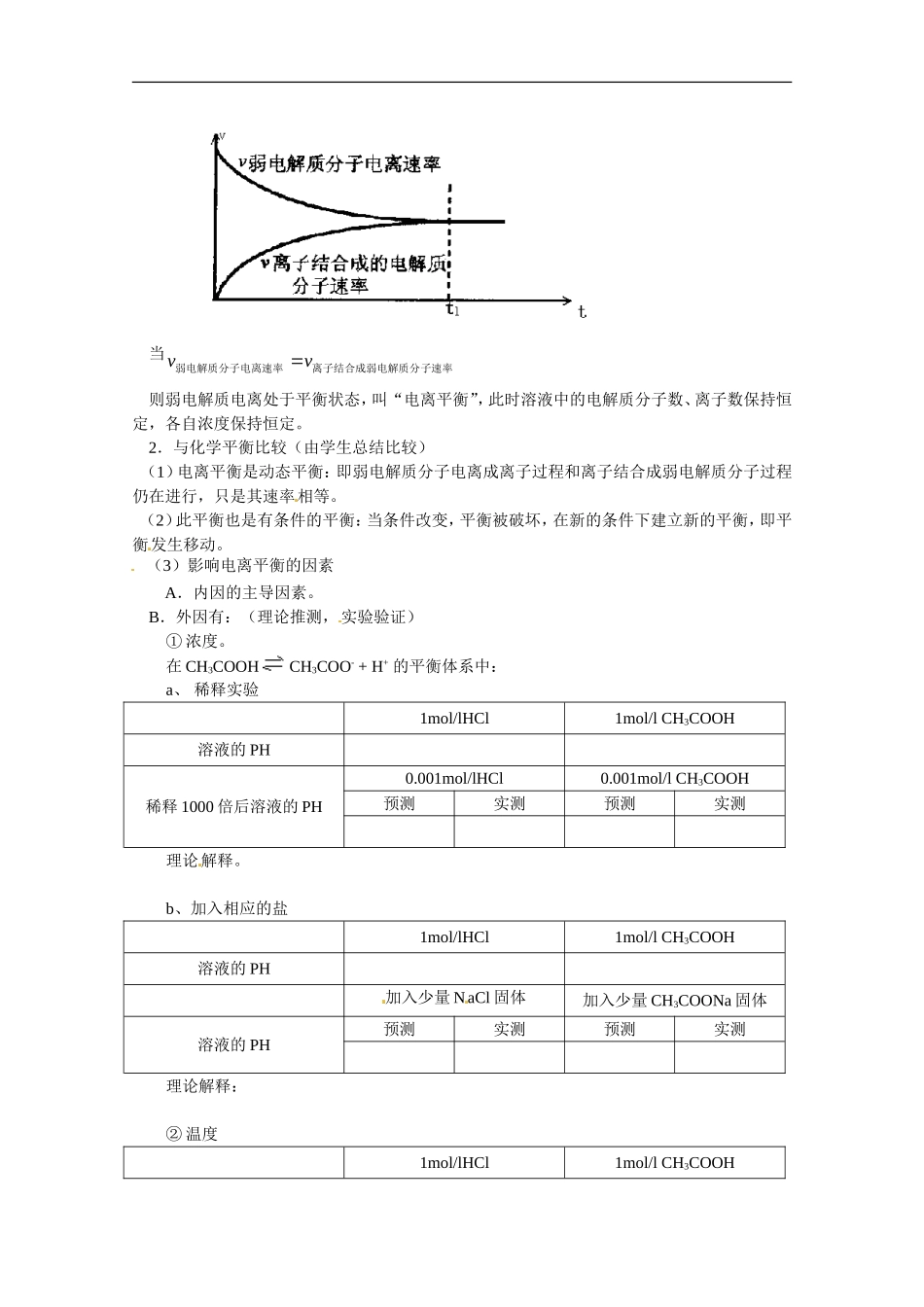
第一节弱电解质的电离教学目标:1.掌握弱电解质的电离平衡。2.了解电离平衡常数的概念。3.了解影响电离平衡的因素重点、难点:外界条件对电离平衡的影响,电离平衡常数。教学方法:实验探究、类比、推理等教学方法结合使用。引入:问题:什么是电解质?哪些物质属于电解质?一、电解质非电解质1.定义:在水溶液中或熔融状态下,能导电的化合物叫电解质。上述两种情况下都不导电的化合物叫非电解质。2.酸、碱、盐都是电解质。二、强电解质,弱电解质1.区分电解质强弱的依据:分组实验3-11mol/lHCl1mol/lCH3COOH与镁条反应现象实验结论分组实验3-11mol/lHCl1mol/lCH3COOH溶液的PH(用PH计测定)实验结论2.电离方程式:(1)强电解质:HCl=H++Cl-(2)弱电解质:CH3COOHCH3COO-+H+3.强弱电解质与结构关系。(1)强电解质:强碱、强酸和多数盐;(2)弱电解质:弱酸、弱碱和水等。三、弱电解质电离平衡1.电离平衡定义在一定条件下(如温度,浓度),当电解质分子电离成离子的速率和离子重新结合成分子的速度相等时,电离过程就达到了平衡状态,这叫做电离平衡。弱电解质电离过程(用图像分析建立)当子速率离子结合成弱电解质分弱电解质分子电离速率vv则弱电解质电离处于平衡状态,叫“电离平衡”,此时溶液中的电解质分子数、离子数保持恒定,各自浓度保持恒定。2.与化学平衡比较(由学生总结比较)(1)电离平衡是动态平衡:即弱电解质分子电离成离子过程和离子结合成弱电解质分子过程仍在进行,只是其速率相等。(2)此平衡也是有条件的平衡:当条件改变,平衡被破坏,在新的条件下建立新的平衡,即平衡发生移动。(3)影响电离平衡的因素A.内因的主导因素。B.外因有:(理论推测,实验验证)①浓度。在CH3COOHCH3COO-+H+的平衡体系中:a、稀释实验1mol/lHCl1mol/lCH3COOH溶液的PH稀释1000倍后溶液的PH0.001mol/lHCl0.001mol/lCH3COOH预测实测预测实测理论解释。b、加入相应的盐1mol/lHCl1mol/lCH3COOH溶液的PH加入少量NaCl固体加入少量CH3COONa固体溶液的PH预测实测预测实测理论解释:②温度1mol/lHCl1mol/lCH3COOH溶液的PH加热后溶液的PH预测实测预测实测理论解释:电离过程是一个吸热过程,所以,升高温度,平衡向电离方向移动。练习:完成下表在氨水中进行如下实验操作操作/项目PH[OH-][NH4+][NH3H2O]加入NH4Cl固体加入NaOH固体加入HCl溶液3.电离平衡常数(自学点拨)实验3-2(分组)1mol/l硼酸1mol/lCH3COOH溶液的PH加入Na2CO3溶液现象实验结论及解释:(1)一元弱酸电离平衡常数:akCOOHCH3HCOOCH3)COOH(CH)H()COOCH(33acccK(2)一元弱碱电离平衡常数:bkOHNH23OHNH4)OH(NH)NH()OH(234bcccK(3)多元弱酸是分步电离,每步各有电离常数。如:43POH43POH42POHH31105.7K42POH24HPOH82102.6K24HPO34POH133102.2K(4)电离平衡常数只随温度变化而变化,而与浓度无关。(5)K的意义:①电离平衡常数化是温度函数,温度不变K不变。②k值越大,该弱电解质较易电离,其对应的弱酸弱碱较强;k值越小,该弱电解质越难电离,其对应的弱酸弱碱越弱;即k值大小可判断弱电解质相对强弱。③多元弱酸是分步电离的,一级电离程度较大,产生H,对二级、三级电离产生抑制作用。