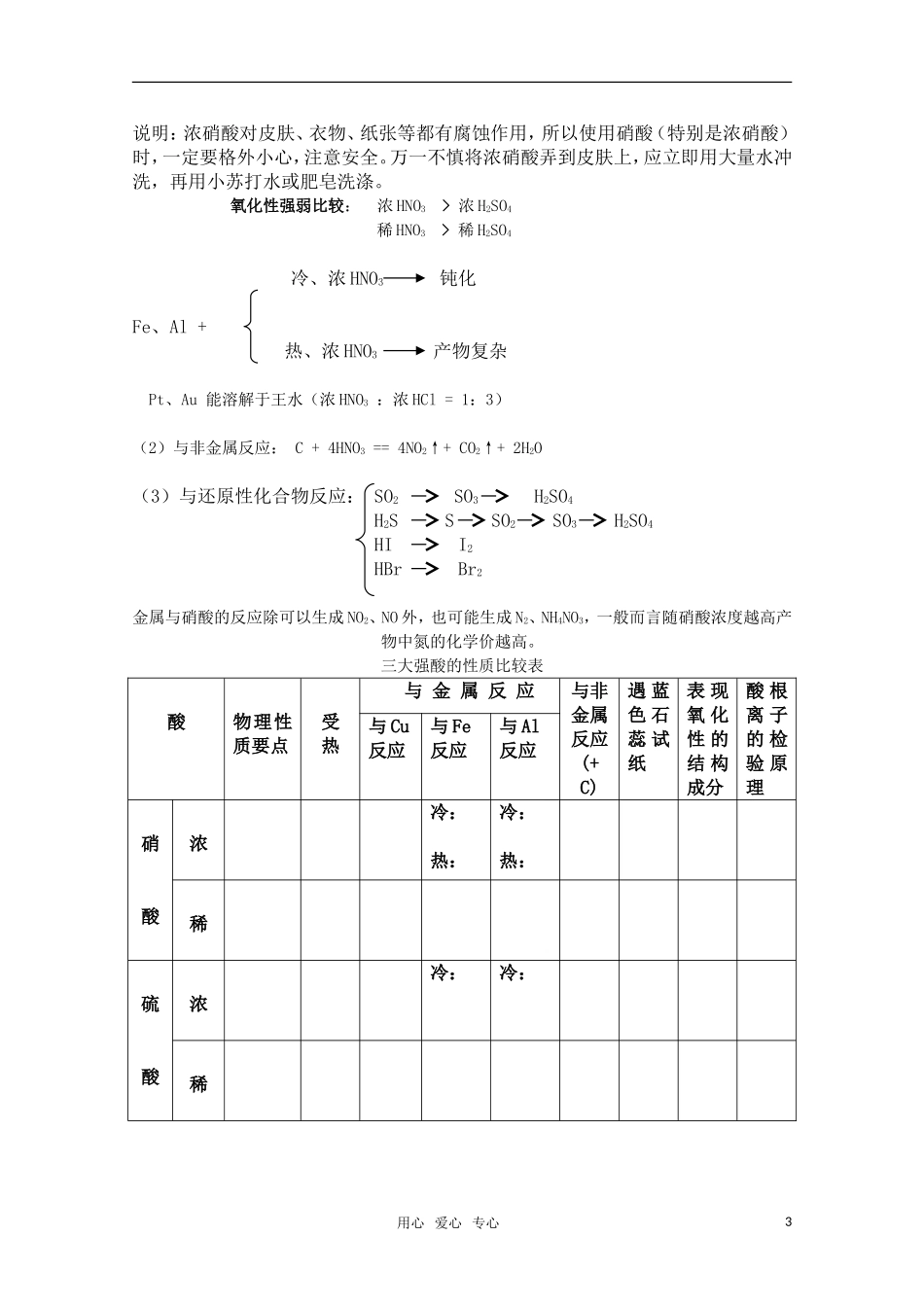
第三节硝酸教学目的:1、掌握硝酸的制备。2、牢固掌握硝酸的重要性质。3、能熟练进行有关硝酸生成的计算,通过习题教学,培养学生思维的敏捷性、多向性和严密性。教学重点:1、硝酸的不稳定性和强氧化性。2、有关硝酸生成的计算。教学难点:考题中发现硝酸的存在,并用强氧化性解题。教学过程:1:HNO3中N处于最高的+5价态,但N元素是较强的非金属元素,有明显的得电子倾向,上述存在的矛盾使得HNO3里的+5价的N力求降低价态,这是HNO3具有氧化性的原因。所以,浓硝酸见光分解的不稳定性,实质上是+5价N的强氧化性。2:HNO3浓度越大,氧化性越强,在反应中N的化合价不必降得较低,就能将还原剂氧化;HNO3浓度越小,氧化性越弱,在反应中N的化合价需要降得更低,才能将还原剂氧化。一,硝酸的物理性质色味态密度熔沸点挥发性浓硝酸发烟硝酸二,硝酸的化学性质1,酸的通性酸通性中的氧化性:(1)石蕊试液:红褪色(2)+金属:无H2产生(3)+低价碱性氧化物产生高价盐(4)+低价碱(5)+盐:若产生新酸或新盐有还原性,则会继续发生氧化还原反应2:不稳定性硝酸见光或受热分解的化学方程式。不稳定性:4HNO3===4NO2+O2+2H2O硝酸溶液通常呈现黄色是由于其分解产物NO2溶入其中所致,可以通过向其中通入空气(或氧气)除去,发生的反应方程式:4NO2+O2+2H2O===4HNO3[小结]①久置的硝酸常呈黄色,是由于分解生成的NO2溶于硝酸的缘故。②实验室制HNO3时,不强热而用微热,是尽可能减少硝酸分解。易挥发性只用蓝色石蕊试纸鉴别三瓶失去标签的液体:浓HCl、浓H2SO4、浓HNO3。[演示]各取少量试液分放于三支试管,分别用玻璃棒蘸取试液滴到湿润的蓝色石蕊试纸上(湿润的试纸先放在点滴板上),再加热。[小结]①浓硝酸:变红色→红色褪去(具有酸性、氧化性)②浓硫酸:变红色→变黑色(具有酸性、脱水性)③浓盐酸:变红色→红色不变(具有酸性)强酸性用心爱心专心1写出硝酸与下对物质反应的离子方程式:①NH3•H2O②Ba(OH)2③CuO④Na2CO3⑤Ca(HCO3)2[讲解]硝酸的强酸性,可从理论上加以说明,硝酸是强电解质,在水溶液中几乎完全电离成H十和NO3一。[讨论]只用铜丝鉴别三瓶失去标签的液体:浓HCl、浓H2SO4、浓HNO3。[演示]各取少量试液分放于三支试管,分别插入铜丝。[小结]浓硝酸:立即反应,产生红棕色气体,溶液变蓝色(具有强氧化性)浓硫酸:无现象,加热后产生刺激性气体,溶液变蓝色(具有强氧化性)浓盐酸:无现象,加热后仍无现象(非氧化性酸)2:强氧化性(不论稀、浓)本质:HNO3中的+5价N元素具有很强的得电子能力。完成下列化学方程式:①Cu+HNO3(浓)——②Cu+HNO3(稀)——③Mg+HNO3(极稀)——N2O或NH4NO3④Fe+HNO3(稀,过量)——⑤Fe(过量)+HNO3(稀)——⑥C+HNO3(浓)——⑦FeO+HNO3(稀)——⑧Na2SO3+HNO3(稀)——⑨H2S+HNO3(稀)——强氧化性:能与绝大多数金属(除Pt、Au)或非金属(S、C、P),及很多还原性化学物如(SO2、SO32-、H2S、S2-、Fe2+、HI、I-),其氧化性随浓度的增大而增强,浓硝酸的强氧化性可以使石蕊试液、试纸退色。规律:①HNO3(浓)NO2HNO3(稀)NO②硝酸越浓,其氧化性就越强。③还原剂一般被氧化成最高价态。①实验室制取硝酸的装置中不能用橡皮接头和橡皮塞,而用特制的曲颈甑。这是因为橡胶中含有不饱和的双键,具有还原性,被硝酸氧化而腐蚀。②常温下,浓硝酸对铁、铝等金属有钝化作用。故用铁槽车运输浓硝酸。③除Pt、Au等少量金属外,其余金属几乎都能与硝酸反应,其反应的一般规律如下:不产生氢气,浓硝酸主要被还原成NO2,稀硝酸主要被还原成NO。中学化学有关HNO3氧化性表现的认识,包括以下范围:浓HNO3NO2①Cu++H2O+NO3-盐(Zn—Ag)稀HNO3NO等(1)与金属反应②Fe、Al+冷、浓HNO3发生“钝化”;热与①同③Pt、Au溶于“王水”(HNO3:HCl=1:3)(2)与非金属反应:如C+HNO3(浓)====↑+↑+S+6HNO3===H2SO4+2H2O+4NO2P+5HNO3===H3PO4+H2O+5NO2(3)与还原性化合物反应(如:SO2、H2S、HBr、HI、Fe2+等)氧化H2S-——S或H2SO4SO2——H2SO4SO32-——SO42-Fe2+——Fe3+I---——I2写出浓硝酸与氧化亚铁的化学反应方程式,...