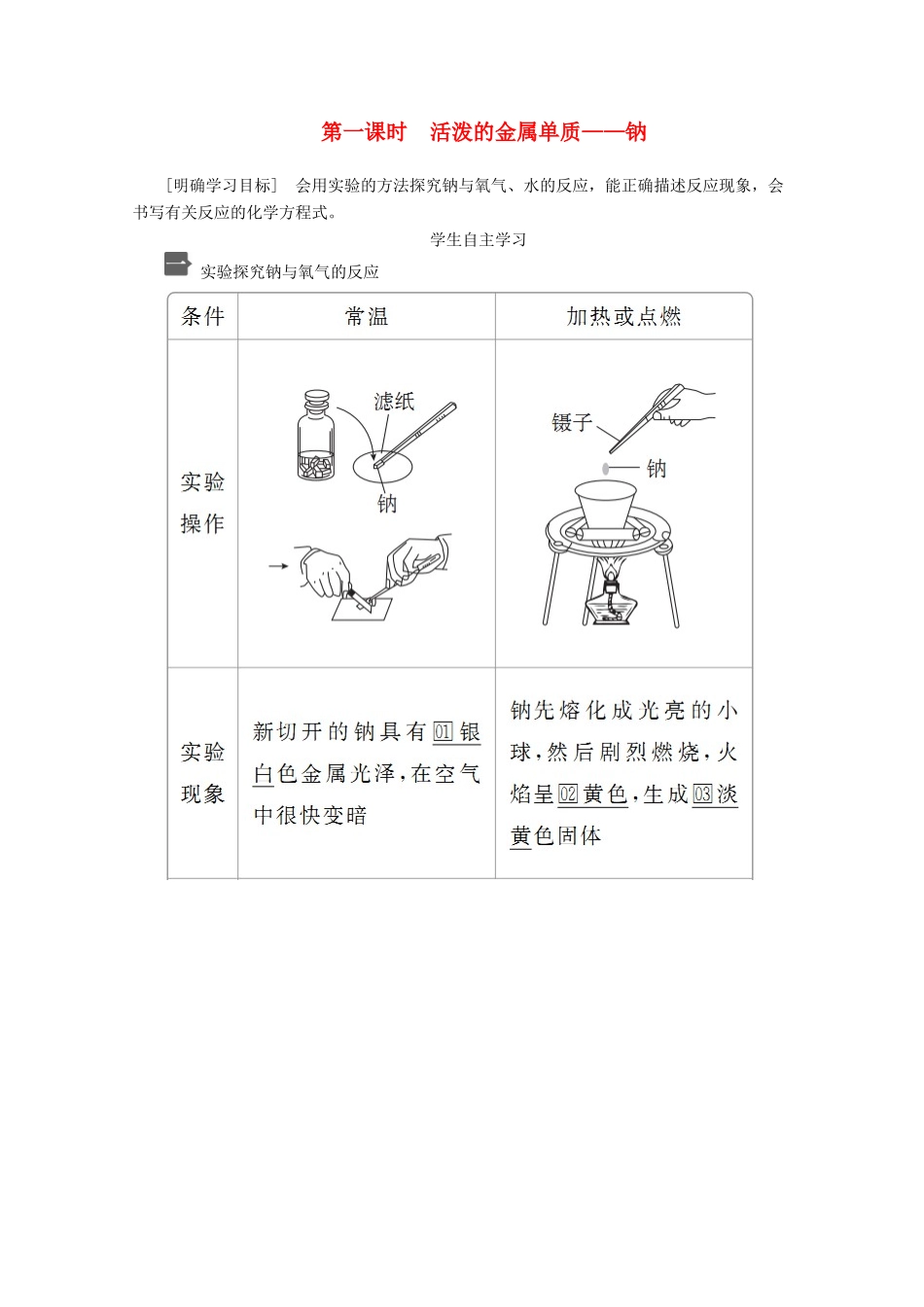
第一课时活泼的金属单质——钠[明确学习目标]会用实验的方法探究钠与氧气、水的反应,能正确描述反应现象,会书写有关反应的化学方程式。学生自主学习实验探究钠与氧气的反应实验探究钠与水的反应1.取用钠时,剩余的钠要放回原试剂瓶,为什么?提示:钠性质活泼,易与水、空气反应而引起火灾,故剩余的钠不能随意丢弃,应放回原试剂瓶。2.钠能置换出金属单质吗?提示:钠与盐溶液反应时,不能置换出盐中的金属。但是在熔融状态下,金属钠能将不活泼的金属置换出来,如4Na+TiCl4=====4NaCl+Ti。课堂互动探究知识点一钠与非金属单质的反应(1)钠原子最外层有一个电子,在化学反应中极易失去,故钠具有强的还原性。(2)钠在常温下能与O2反应生成Na2O;在加热(或点燃)条件下与O2反应生成Na2O2,与Cl2反应生成NaCl;在研磨时与S反应生成Na2S。1下列叙述错误的是()A.金属钠在自然界中只能以化合物的形式存在B.钠燃烧时发出黄色火焰C.钠与煤油混合时可以发生爆炸D.钠在空气中燃烧可生成过氧化钠[批注点拨][解析]钠易与H2O和O2反应,所以自然界中不存在钠的单质,都是化合物,A正确;为了隔绝空气,钠通常保存在煤油中,所以钠与煤油不反应,更不会因混合而发生爆炸;钠在空气中不加热生成Na2O,加热时,燃烧生成Na2O2且发出黄色火焰,B、D正确。[答案]C[练1]下列关于金属钠的叙述错误的是()A.金属钠可以保存在煤油中B.钠元素只能以化合态形式存在于自然界中C.实验室取用金属钠需要3种用品D.钠元素在自然界中主要以NaCl的形式存在答案C解析金属钠在空气中会被氧化,由于钠的密度比煤油大,故钠可以保存在煤油中,A正确;金属钠性质活泼,在自然界中无游离态的钠存在,B正确;实验室取用金属钠时,需要用镊子夹取钠,用滤纸吸干煤油或液体石蜡,用小刀切割,用玻璃皿盛放,所以所需的用品至少有4种,C错误;钠元素在自然界中主要以NaCl的形式存在,D正确。[练2]等质量的两块钠,第一块在足量氧气中加热,第二块与足量氧气在常温下充分反应,则下列说法正确的是()A.第一块钠失去电子数多B.两块钠失去电子数一样多C.第二块钠的反应产物质量较大D.两块钠的反应产物质量一样大答案B解析根据电荷守恒,不论燃烧还是缓慢氧化,最终都是Na→Na,故二者失去的电子数一样多;但燃烧时生成Na2O2,而常温时生成Na2O,故第一块钠反应产物质量大。方法规律在氧化还原反应中,当题目要求计算失电子总数,若由于信息不充足使失电子总数难于计算时,可把反应中氧化剂得电子总数计算出来,失电子总数和得电子总数是相等的。知识点二钠与H2O的反应钠与冷水剧烈反应产生NaOH和H2,钠与水溶液接触时,应先与水溶液中的水接触反应(酸溶液除外)生成NaOH和H2,生成的NaOH可能与溶质反应,如:2将金属钠投入盛有下列溶液的小烧杯中,既有气体生成,又有白色沉淀产生的是(不考虑反应中热量的变化)()①MgSO4溶液②NaCl溶液③Na2SO4溶液④饱和Ca(OH)2溶液⑤CuSO4溶液⑥饱和NaCl溶液A.①②④B.②③⑥C.①④⑥D.④⑤⑥[批注点拨][解析]将钠投入碱或盐的溶液中先发生反应:2Na+2H2O===2NaOH+H2↑。①中再发生反应:Mg2++2OH-===Mg(OH)2↓;④中由于水减少,则有Ca(OH)2析出;⑤中生成蓝色的Cu(OH)2沉淀,不符合题目要求;⑥中由于水减少,则有NaCl析出。[答案]C[练3]某学生将一小块钠投入滴有酚酞的水中,此实验能证明钠下面4点性质中的()①钠的密度比水的小②钠的熔点较低③钠与水反应时放出热量④钠与水反应后溶液呈碱性A.①④B.①②④C.①③④D.①②③④答案D解析钠投入滴有酚酞的水中,钠浮在水面上,说明钠的密度比水小;钠熔成一个闪亮的小球,说明反应放热而且钠的熔点低;溶液变红,说明反应后的溶液呈碱性,故D正确。[练4]将一小块钠放入下列溶液中,既能产生气体又能生成蓝色沉淀的是()A.硝酸铜溶液B.稀硫酸C.氯化钠溶液D.氯化镁溶液答案A解析A项,钠与Cu(NO3)2溶液反应生成沉淀Cu(OH)2,为蓝色,正确;B项,钠与稀H2SO4反应无沉淀生成,错误;C项,钠与NaCl溶液中的水反应无沉淀生成,错误;D项,钠与溶液中的水反应生成H2,同时生成Mg(OH)2白色沉淀,错误。方法规律金属钠活动...