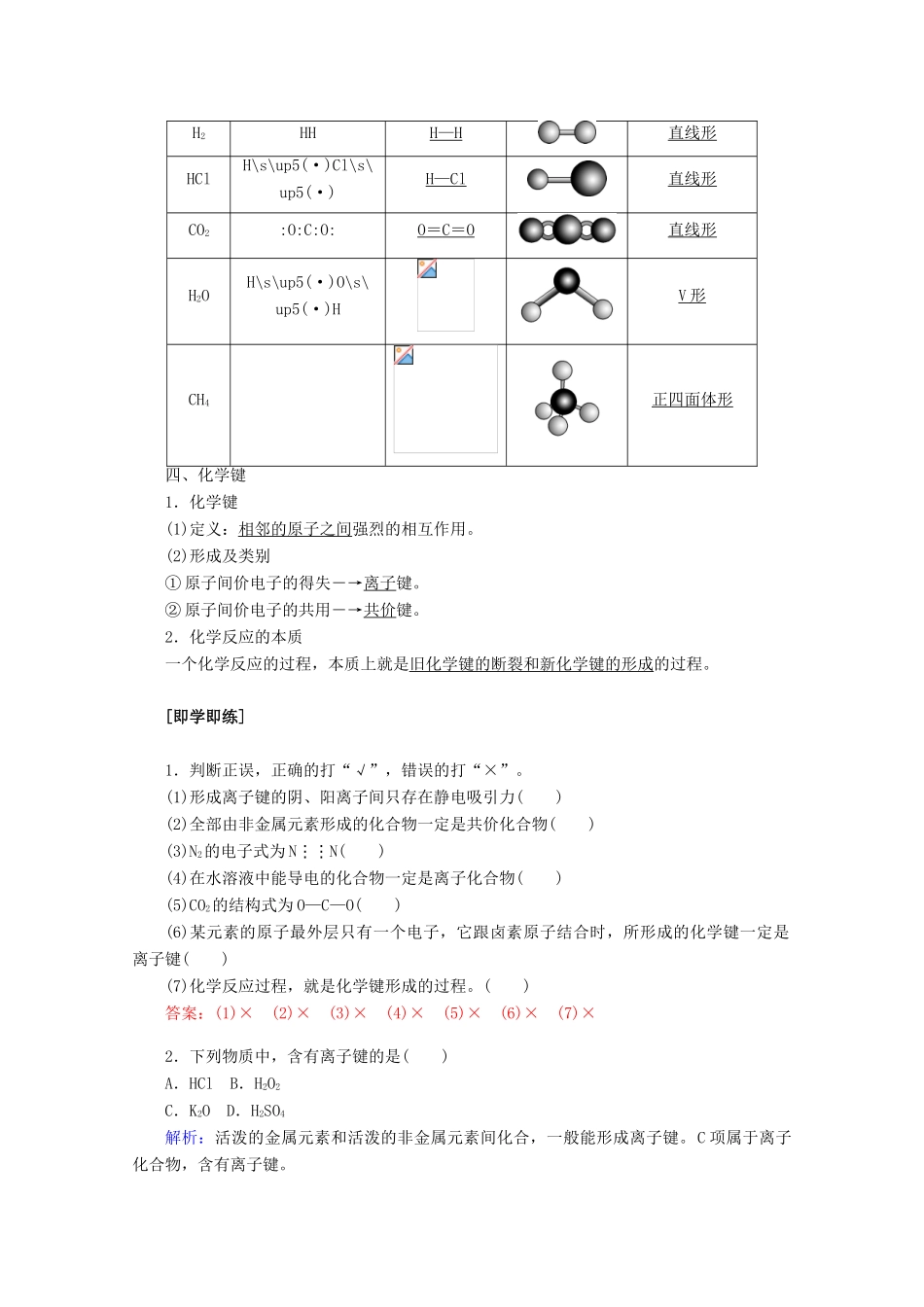
第三节化学键核心微网络素养新目标1.认识离子键和共价键的含义。2.学会用电子式表示离子化合物、共价化合物的形成过程。3.认识非极性键和极性键及常见的分子空间结构。4.理解化学键的含义,并从化学键的角度解释化学反应的本质。学业基础[预习新知]一、离子键1.离子键(1)定义:带相反电荷离子之间的相互作用(2)成键粒子:阴离子和阳离子(3)成键元素:一般是活泼金属元素和活泼非金属元素(4)存在:离子化合物2.离子化合物(1)定义:由离子键构成的化合物(2)形成过程①电子式:在元素符号周围用“·”或“×”来表示原子的最外层电子(价电子)的式子。如原子:NaNa×、Mg×Mg×Cl\s\up5(·)Cl\s\up5(·)、S·S·阳离子:Na+Na+、Mg2+Mg2+;阴离子:Cl-[\s\up5(·)Cl\s\up5(·)]-、S2-[\s\up5(·)S\s\up5(·)]2-。②形成过程:二、共价键1.共价键(1)形成过程(以Cl2形成为例)用电子式表示:(2)定义:原子间通过共用电子对所形成的相互作用。(3)成键粒子:原子。(4)成键元素:同种或不同种非金属元素化合时能形成共价键。(5)存在①非金属元素的多原子单质,如H2、O2、N2。②共价化合物,如CO2、HCl、H2SO4。③某些离子化合物,如NaOH、Na2CO3、NH4Cl。2.共价键的类型共价键分为:极性共价键和非极性共价键。3.共价化合物以共用电子对形成分子的化合物。4.含有共价键分子的表示方法(1)用电子式表示含共价键的粒子单质H2:HH、N2::N⋮⋮N:化合物H2O:H\s\up5(·)O\s\up5(·)H、CO2:\s\up5(·)\s\up5(·)C\s\up5(·)\s\up5(·)、CH4:(2)用电子式表示分子的形成过程N2:CO2:(3)用结构式表示形成共价键的每一对共用电子对用□一根短线表示,并且略去未成键电子的式子。例如:N2:N≡N、HCl:H—Cl、CO2:O===C===O、CH4:三、以共价键形成的分子及其结构分子电子式结构式分子结构模型空间结构H2HHH—H直线形HClH\s\up5(·)Cl\s\up5(·)H—Cl直线形CO2:O:C:O:O=C=O直线形H2OH\s\up5(·)O\s\up5(·)HV形CH4正四面体形四、化学键1.化学键(1)定义:相邻的原子之间强烈的相互作用。(2)形成及类别①原子间价电子的得失―→离子键。②原子间价电子的共用―→共价键。2.化学反应的本质一个化学反应的过程,本质上就是旧化学键的断裂和新化学键的形成的过程。[即学即练]1.判断正误,正确的打“√”,错误的打“×”。(1)形成离子键的阴、阳离子间只存在静电吸引力()(2)全部由非金属元素形成的化合物一定是共价化合物()(3)N2的电子式为N⋮⋮N()(4)在水溶液中能导电的化合物一定是离子化合物()(5)CO2的结构式为O—C—O()(6)某元素的原子最外层只有一个电子,它跟卤素原子结合时,所形成的化学键一定是离子键()(7)化学反应过程,就是化学键形成的过程。()答案:(1)×(2)×(3)×(4)×(5)×(6)×(7)×2.下列物质中,含有离子键的是()A.HClB.H2O2C.K2OD.H2SO4解析:活泼的金属元素和活泼的非金属元素间化合,一般能形成离子键。C项属于离子化合物,含有离子键。答案:C3.下列化学用语正确的是()A.HCl的电子式H+[\s\up5(·)Cl\s\up5(·)]-B.Cl-的结构示意图C.CO2的电子式\s\up5(·)O\s\up5(·)Cl\s\up5(·)O\s\up5(·)D.质量数为37的氯原子Cl答案:B4.下列各式为用电子式表示的物质的形成过程,其中正确的是()解析:A中KBr的电子式为K+[\s\up5(·)Br\s\up5(·)]-,B中弯箭头方向错误,应为C中CaCl2的电子式错误,应为[\s\up5(·)Cl\s\up5(·)]-Ca2+[\s\up5(·)Cl\s\up5(·)]-。答案:D5.下面是一些常见分子的比例模型。其中1个分子中含有共用电子对最多的是()解析:H—H、、、O=C=O分子中共用电子对数依次是1、3、2、4。答案:D6.已知X、Y、Z均为元素周期表中前20号元素,X和Z位于同一周期,Y的阳离子和Z的阴离子的核外电子排布相同,Y2Z2与H2Z或XZ2反应都能生成单质气体Z2。(1)写出元素名称:X________,Y________,Z________。(2)写出下列物质的电子式:Y2Z2________,XZ2________。(3)用电子式表示Y2Z的形成过程:______________________________。解析:由题意知,Z为O;Y为+1价,且Y的阳离子和Z的阴离子的核外电子排布相同,因此Y为Na;Na2O2与XO2反应可生...