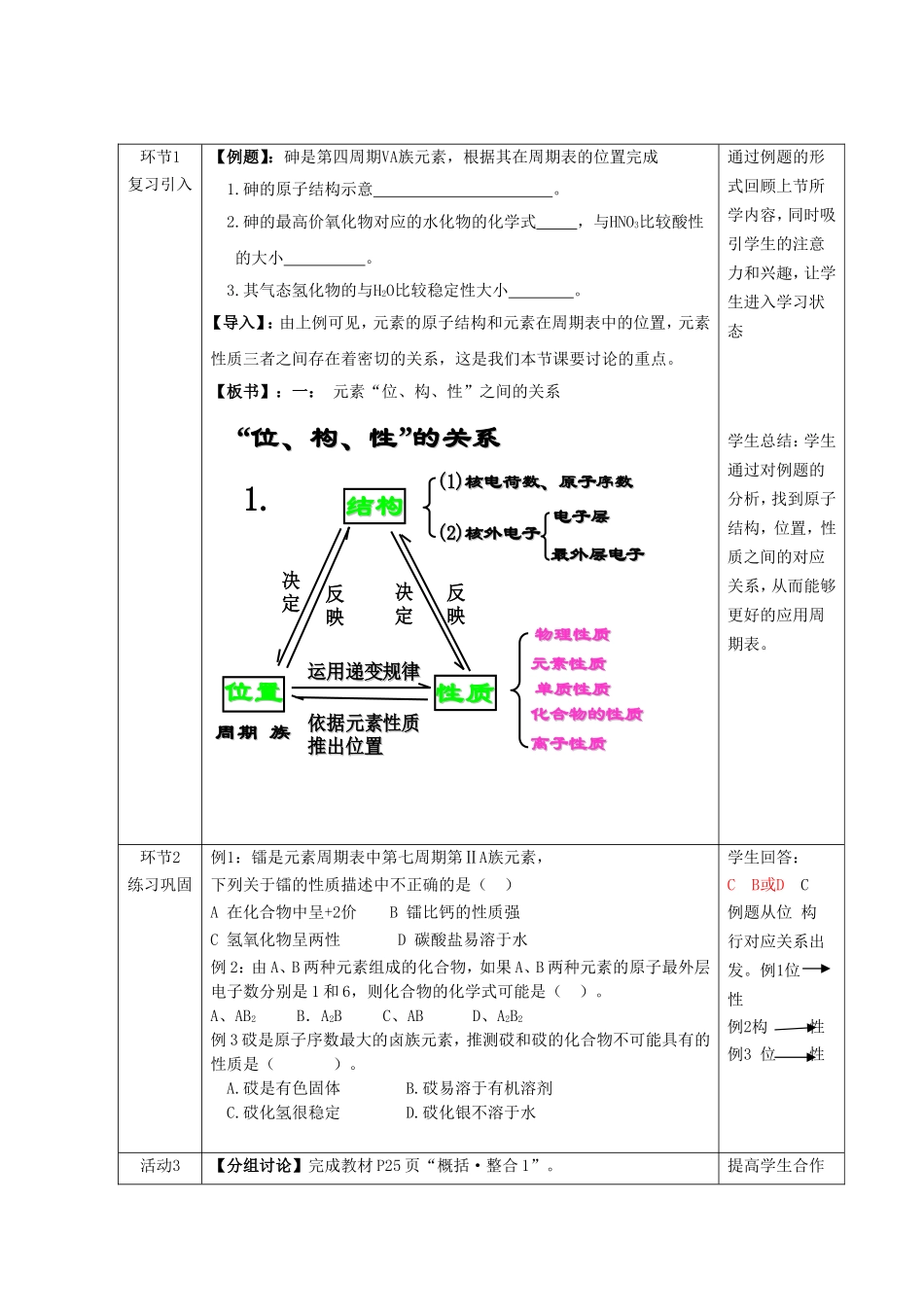
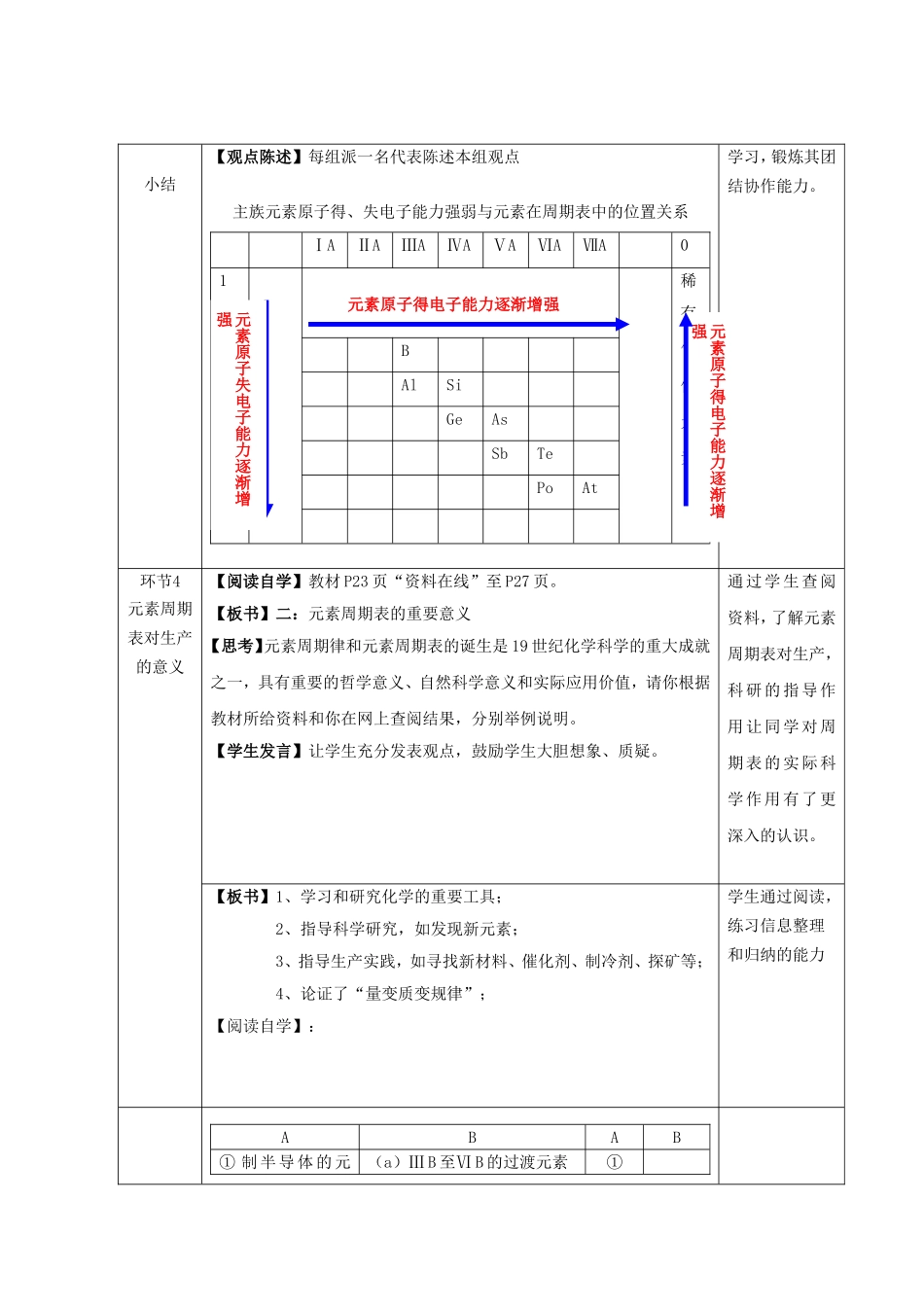
第一章元素周期表的应用(2)元素周期表指导生产实践教学目标:1、以第4周期元素和VA族元素为例,使学生回顾同周期、同主族元素性质递变规律,并能用原子结构理论初步加以解释;2、了解元素“位、构、性”三者间的关系,初步学会运用元素周期表;3、通过“实验探究”、“观察思考”,培养学生实验能力以及对实验结果的分析、处理和总结能力;4、了解元素周期表在指导生产实践等方面的作用;教学重点:1、同周期、同主族元素性质递变规律;2、元素“位、构、性”三者间的关系;教学难点:1.学会在元素周期律和元素周期表指导下探究和学习元素化合物知识的学习方法;教学过程:1、通过“活动·探究”,学会运用具体事物来研究抽象概念的思想方法;2、通过“阅读探究”、“交流·研讨”、“观察思考”等活动,培养学生取并整合信息的能力;3、通过对本节内容的整体学习,学会运用元素周期律和元素周期表指导探究化学知识的学习方法;教学过程:环节教学内容设计目的环节1复习引入【例题】:砷是第四周期VA族元素,根据其在周期表的位置完成1.砷的原子结构示意。2.砷的最高价氧化物对应的水化物的化学式,与HNO3比较酸性的大小。3.其气态氢化物的与H2O比较稳定性大小。【导入】:由上例可见,元素的原子结构和元素在周期表中的位置,元素性质三者之间存在着密切的关系,这是我们本节课要讨论的重点。【板书】:一:元素“位、构、性”之间的关系““位、构、性位、构、性””的关系的关系结构结构位置位置性质性质周期周期族族依据依据元素性质元素性质推出位置推出位置(1)(1)核电荷数、原子序数核电荷数、原子序数(2)(2)核外电子核外电子电子层电子层最外层电子最外层电子物理性质物理性质元素性质元素性质单质性质单质性质化合物的性质化合物的性质离子性质离子性质1.决定反映决定反映运用递变规律运用递变规律通过例题的形式回顾上节所学内容,同时吸引学生的注意力和兴趣,让学生进入学习状态学生总结:学生通过对例题的分析,找到原子结构,位置,性质之间的对应关系,从而能够更好的应用周期表。环节2练习巩固例1:镭是元素周期表中第七周期第ⅡA族元素,下列关于镭的性质描述中不正确的是()A在化合物中呈+2价B镭比钙的性质强C氢氧化物呈两性D碳酸盐易溶于水例2:由A、B两种元素组成的化合物,如果A、B两种元素的原子最外层电子数分别是1和6,则化合物的化学式可能是()。A、AB2B.A2BC、ABD、A2B2例3砹是原子序数最大的卤族元素,推测砹和砹的化合物不可能具有的性质是()。A.砹是有色固体B.砹易溶于有机溶剂C.砹化氢很稳定D.砹化银不溶于水学生回答:CB或DC例题从位构行对应关系出发。例1位性例2构性例3位性活动3【分组讨论】完成教材P25页“概括·整合1”。提高学生合作小结【观点陈述】每组派一名代表陈述本组观点主族元素原子得、失电子能力强弱与元素在周期表中的位置关系ⅠAⅡAⅢAⅣAⅤAⅥAⅦA01稀有气体元素2B3AlSi4GeAs5SbTe6PoAt7学习,锻炼其团结协作能力。环节4元素周期表对生产的意义【阅读自学】教材P23页“资料在线”至P27页。【板书】二:元素周期表的重要意义【思考】元素周期律和元素周期表的诞生是19世纪化学科学的重大成就之一,具有重要的哲学意义、自然科学意义和实际应用价值,请你根据教材所给资料和你在网上查阅结果,分别举例说明。【学生发言】让学生充分发表观点,鼓励学生大胆想象、质疑。通过学生查阅资料,了解元素周期表对生产,科研的指导作用让同学对周期表的实际科学作用有了更深入的认识。【板书】1、学习和研究化学的重要工具;2、指导科学研究,如发现新元素;3、指导生产实践,如寻找新材料、催化剂、制冷剂、探矿等;4、论证了“量变质变规律”;【阅读自学】:学生通过阅读,练习信息整理和归纳的能力ABAB①制半导体的元(a)ⅢB至ⅥB的过渡元素①元素原子得电子能力逐渐增强元素原子得电子能力逐渐增强元素原子失电子能力逐渐增强素②制催化剂的元素(b)F、Cl、Br、N、S“三角地带”②③制耐高温材料的元素(c)金属与非金属元素分界线附近③④制冷剂的元素(d)相对原子质量较小的元素④⑤地壳中含量较多的元素(e)过渡元素⑤...