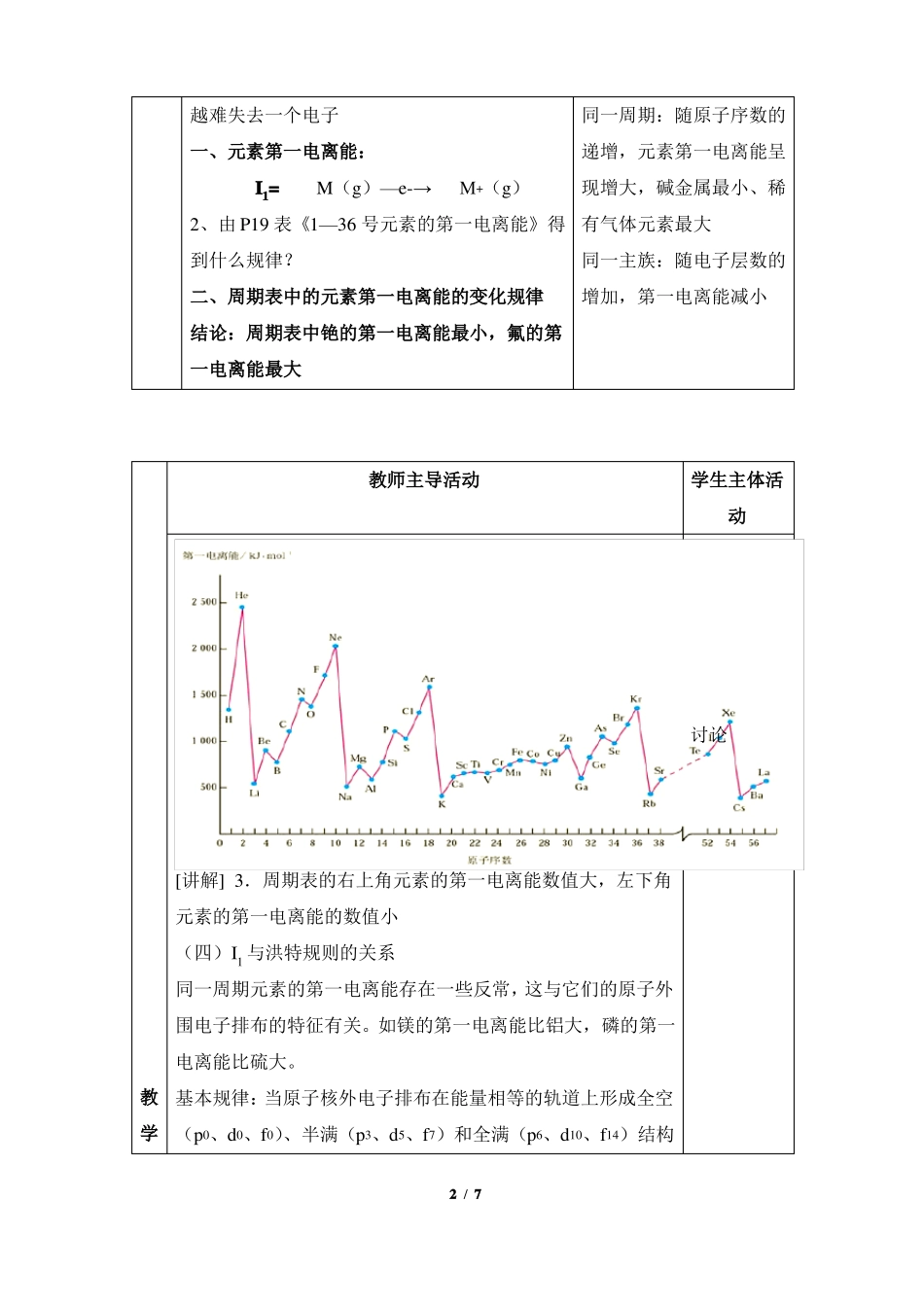
教学课题专题单元节题专题2原子结构与元素的性质第二单元元素性质的递变规律元素第一电离能的周期性变化知识与技能1、能说出元素电离能的含义。2、认识周期表中同一周期和同一主族中元素第一电离能的变化规律教学目标3、了解元素第一电离能和元素原子的核外电子排布的关系。4、能应用元素第一电离能说明原子失去电子的难易。过程与方法进一步丰富物质结构的知识,提高分析问题和解决问题的能力和窨想象能力。情感态度与价值观教学重点从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,增强学习化学的兴趣;认识周期表中同一周期和同一主族中元素第一电离能的变化规律教学难点教学方法教学准备能应用元素第一电离能说明原子失去电子的难易探究讲练结合教师主导活动教学过程[回顾]元素周期律?[提问]1、什么叫第一电离能?回答学生主体活动[讲解]第一电离能其数值越大,原子越难于失去一个电子。气态原子失去一个电子注意:原子失去电子,应先最外电子层、最外形成+1价气态阳离子所原子轨道上的电子;第一电离能的作用:可衡需的最低能量量元素的原子失去一个电子的难易程度。I1越小,原子越容易失去一个电子;I1越大,原子1/7越难失去一个电子一、元素第一电离能:I1=M(g)—e-→M+(g)同一周期:随原子序数的递增,元素第一电离能呈现增大,碱金属最小、稀2、由P19表《1—36号元素的第一电离能》得有气体元素最大到什么规律?二、周期表中的元素第一电离能的变化规律同一主族:随电子层数的增加,第一电离能减小结论:周期表中铯的第一电离能最小,氟的第一电离能最大讨论教师主导活动学生主体活动[讲解]3.周期表的右上角元素的第一电离能数值大,左下角元素的第一电离能的数值小(四)I1与洪特规则的关系同一周期元素的第一电离能存在一些反常,这与它们的原子外围电子排布的特征有关。如镁的第一电离能比铝大,磷的第一电离能比硫大。教基本规律:当原子核外电子排布在能量相等的轨道上形成全空学(p0、d0、f0)、半满(p3、d5、f7)和全满(p6、d10、f14)结构2/7过时,原子的能量较低,该元素具有较大的第一电离能程[讲解]应用:1、2、判断元素活动性(金属性、非金属性)推测原子核外电子排布(最外电子数、常见化合价)[典型例题]1、根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。元素代号QRSTUI12080500740580420I2I3I49400950010500116005900理解教师主导活动(1)在周期表中,最可能处于同一族的是()A、Q和RB、S和TC、T和UD、R和TE、R和U学生主体活动答案:(1)E(2)D(3)4000610046006900150077001800270031004400教(2)电解它们的熔融氯化物,阴极电极反应式最可能正确B(4)A(5)学的是E过AQ2++2e-→QBR2++2e-→RCS3++3e-程→SDT3++3e-→TEU2++2e-→U(3)它们的氯化物的化学式,最可能正确的是()AQCl2BRClCSCl3DTClEUCl43/7(4)S元素最可能是()AS区元素B稀有气体元素Cp区元素D过渡金属Ed区元素(5)下列元素中,化学性质和物理性质最像Q元素的是()A硼(1s22s22p1)B铍(1s22s2)C锂(1s22s1)D氢(1s1)E氦(1s2)解析:从图可以看出,Q元素第一电离能大,二、三电离能也较大,但相差不大;应具有稳定结构;R元素第一电离能较小,而二、三电离能也较大,相差不大,可能+1价S元素第一、二电离能相差不大,可能同能级(+2价)T元素第一、二、三电离能相差不大,而与第三层相差较大,最外层3个电子U元素第一电离能较小,而二、三电离能也较大,相差不大,单电子活泼。板一、元素第一电离能:书I1=M(g)—e-→M+(g)计二、周期表中的元素第一电离能的变化规律划结论:周期表中铯的第一电离能最小,氟的第一电离能最大。三、电离能与核外电子排布1、当原子核外电子排布在能量相同的轨道上形成全空(P0、d0、f0)、半满、全满结构时,原子的能量较低,该元素具有较大的第一电离能。2、通常:I1