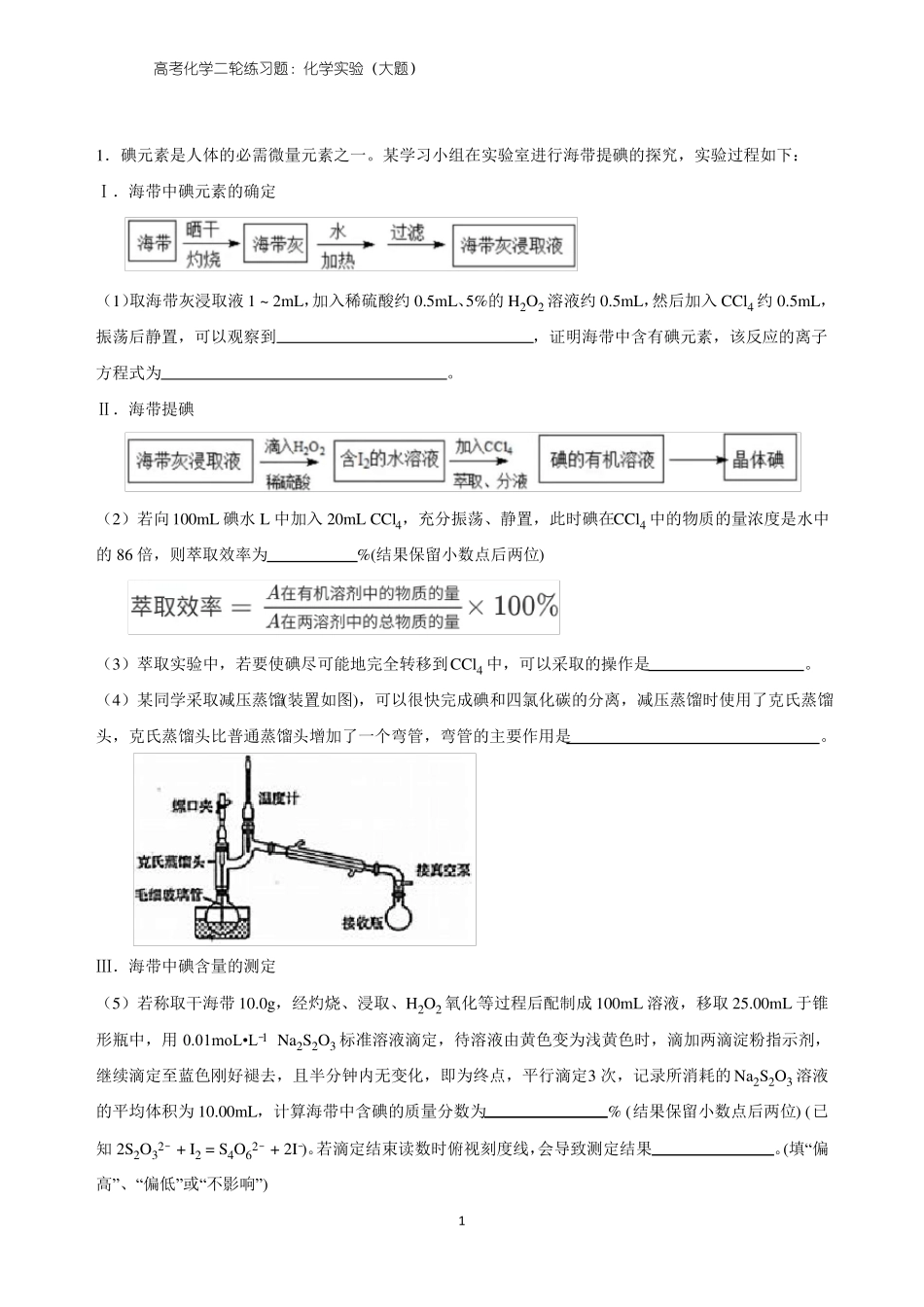
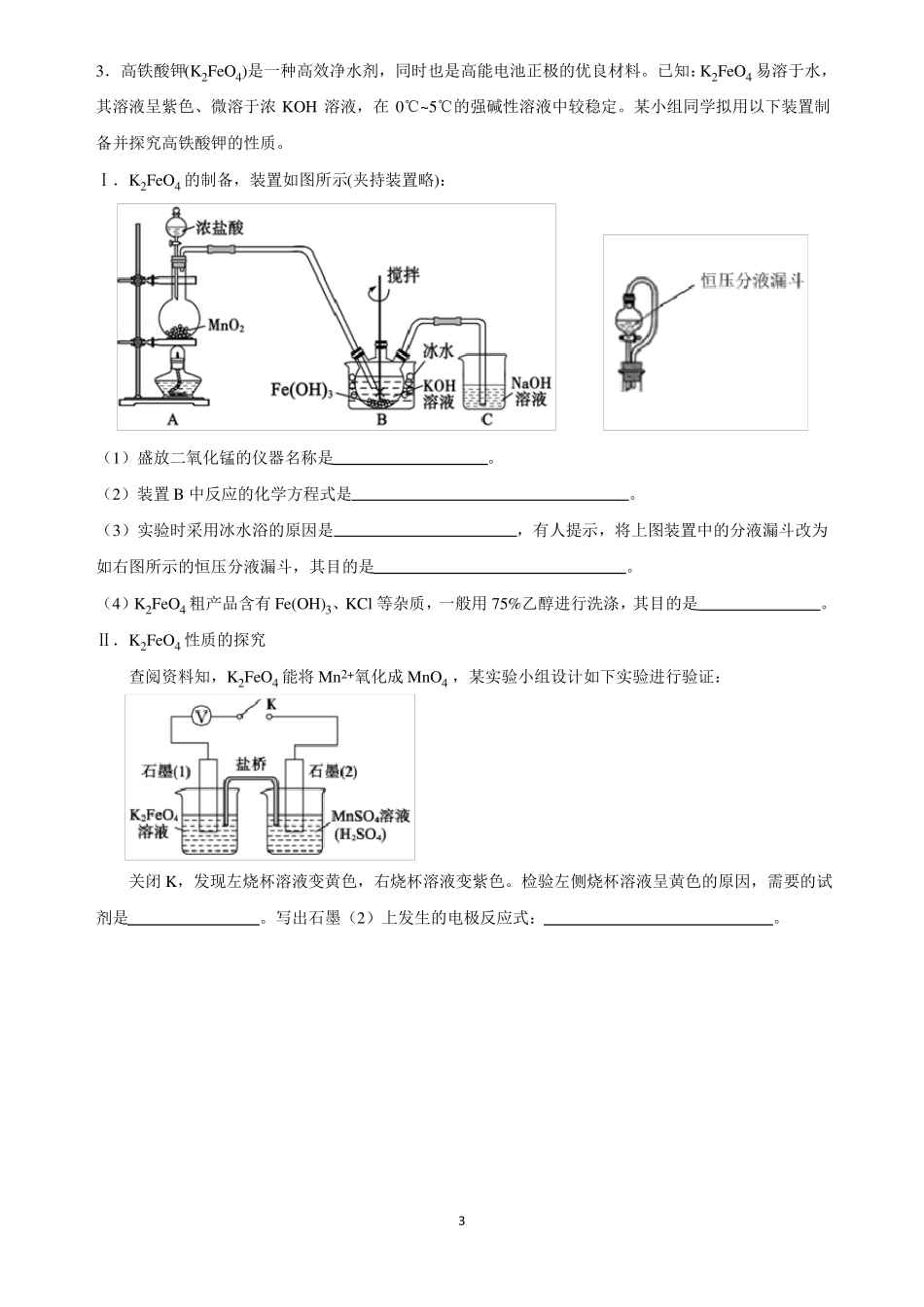
高考化学二轮练习题:化学实验(大题)1.碘元素是人体的必需微量元素之一。某学习小组在实验室进行海带提碘的探究,实验过程如下:Ⅰ.海带中碘元素的确定(1)取海带灰浸取液1~2mL,加入稀硫酸约0.5mL、5%的H2O2溶液约0.5mL,然后加入CCl4约0.5mL,振荡后静置,可以观察到,证明海带中含有碘元素,该反应的离子方程式为。Ⅱ.海带提碘(2)若向100mL碘水L中加入20mLCCl4,充分振荡、静置,此时碘在CCl4中的物质的量浓度是水中的86倍,则萃取效率为%(结果保留小数点后两位)(3)萃取实验中,若要使碘尽可能地完全转移到CCl4中,可以采取的操作是。(4)某同学采取减压蒸馏(装置如图),可以很快完成碘和四氯化碳的分离,减压蒸馏时使用了克氏蒸馏头,克氏蒸馏头比普通蒸馏头增加了一个弯管,弯管的主要作用是。Ⅲ.海带中碘含量的测定(5)若称取干海带10.0g,经灼烧、浸取、H2O2氧化等过程后配制成100mL溶液,移取25.00mL于锥形瓶中,用0.01moL•L1Na2S2O3标准溶液滴定,待溶液由黄色变为浅黄色时,滴加两滴淀粉指示剂,继续滴定至蓝色刚好褪去,且半分钟内无变化,即为终点,平行滴定3次,记录所消耗的Na2S2O3溶液的平均体积为10.00mL,计算海带中含碘的质量分数为%(结果保留小数点后两位)(已知2S2O32+I2=S4O62+2I)。若滴定结束读数时俯视刻度线,会导致测定结果。(填“偏高”、“偏低”或“不影响”)1−−−−2.环己酮是重要的工业溶剂和化工原料。实验室可通过环己醇氧化制环己酮,其反应原理如下:已知:反应时强烈放热;过量氧化剂会将环己醇氧化为己二酸。物质环己醇环己酮实验步骤:Ⅰ.配制氧化液:将5.5g重铬酸钠配成溶液,再与适量浓硫酸混合,得橙红色溶液,冷却备用。Ⅱ.氧化环己醇:向盛有5.3mL环己醇的反应器中分批滴加氧化液,控制反应温度在55~60℃,搅拌20min。Ⅲ.产物分离:向反应器中加入一定量水和几粒沸石,改为蒸馏装置,馏出液为环己酮和水的混合液。Ⅳ.产品提纯:馏出液中加入NaCl至饱和,分液,水相用乙醚萃取,萃取液并入有机相后加入无水MgSO4干燥,水浴蒸除乙醚,改用空气冷凝管蒸馏,收集到151~156℃的馏分2.5g。回答下列问题:(1)铬酸钠溶液与浓硫酸混合的操作是。(2)氧化装置如图所示(水浴装置略):相对分子质量10098沸点161.1155.6密度(g•cm3,20℃)0.96241.9478溶解性能溶于水和醚微溶于水,能溶于醚①反应器的名称是;控制反应温度在55~60℃的措施除分批滴加氧化液外,还应采取的方法是。②温度计示数开始下降表明反应基本完成,此时若反应混合物呈橙红色,需加入少量草酸,目的是。(3)产品提纯时加入NaCl至饱和的目的是。分液时有机相从分液漏斗的(填“上”或“下”)口(填“流出”或“倒出”);用乙醚萃取水相的目的是。(4)由环己醇用量估算环己酮产率为。23.高铁酸钾(K2FeO4)是一种高效净水剂,同时也是高能电池正极的优良材料。已知:K2FeO4易溶于水,其溶液呈紫色、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。某小组同学拟用以下装置制备并探究高铁酸钾的性质。Ⅰ.K2FeO4的制备,装置如图所示(夹持装置略):(1)盛放二氧化锰的仪器名称是。(2)装置B中反应的化学方程式是。(3)实验时采用冰水浴的原因是,有人提示,将上图装置中的分液漏斗改为如右图所示的恒压分液漏斗,其目的是。(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,一般用75%乙醇进行洗涤,其目的是。Ⅱ.K2FeO4性质的探究查阅资料知,K2FeO4能将Mn2+氧化成MnO4,某实验小组设计如下实验进行验证:关闭K,发现左烧杯溶液变黄色,右烧杯溶液变紫色。检验左侧烧杯溶液呈黄色的原因,需要的试剂是。写出石墨(2)上发生的电极反应式:。34.碘酸钙[Ca(IO3)2]是广泛使用的既能补钙又能补碘的新型食品添加剂,不溶于乙醇,在水中的溶解度随温度降低而减小。实验室制取Ca(IO3)2的流程如图1所示。已知:碘酸(HIO3)是易溶于水的强酸,不溶于有机溶剂。(1)实验流程中“转化”步骤是为了制得碘酸,该过程在图2所示的装置中进行。①当观察到三颈瓶中现象时,停止通入氯气。②“转化”时发生反应的离子方程式为。(2)“分离”时用到的玻璃仪器有烧杯、。(3)采...