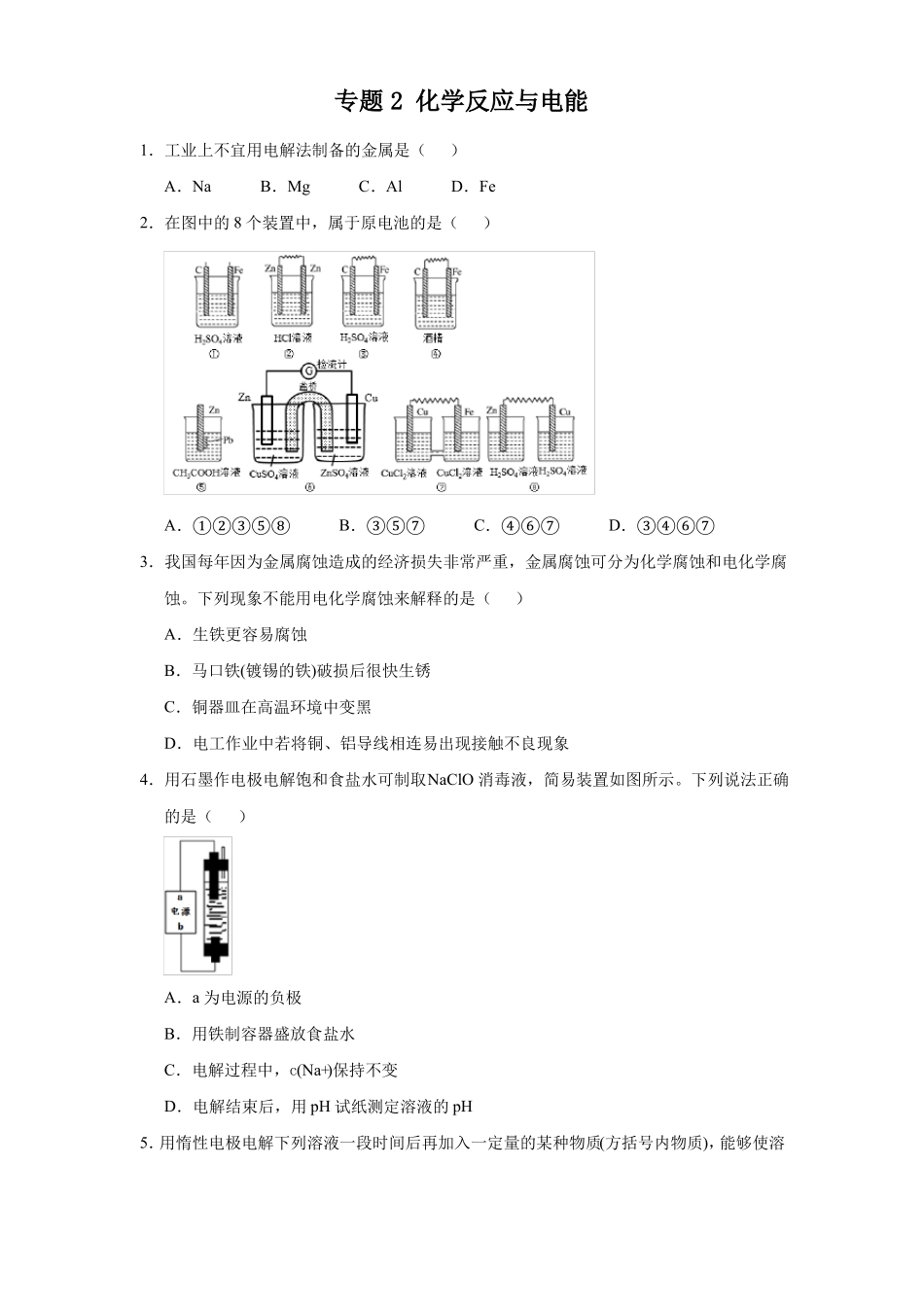
专题2化学反应与电能1.工业上不宜用电解法制备的金属是()A.NaB.MgC.AlD.Fe2.在图中的8个装置中,属于原电池的是()A.①②③⑤⑧B.③⑤⑦C.④⑥⑦D.③④⑥⑦3.我国每年因为金属腐蚀造成的经济损失非常严重,金属腐蚀可分为化学腐蚀和电化学腐蚀。下列现象不能用电化学腐蚀来解释的是()A.生铁更容易腐蚀B.马口铁(镀锡的铁)破损后很快生锈C.铜器皿在高温环境中变黑D.电工作业中若将铜、铝导线相连易出现接触不良现象4.用石墨作电极电解饱和食盐水可制取NaClO消毒液,简易装置如图所示。下列说法正确的是()A.a为电源的负极B.用铁制容器盛放食盐水C.电解过程中,c(Na+)保持不变D.电解结束后,用pH试纸测定溶液的pH5.用惰性电极电解下列溶液一段时间后再加入一定量的某种物质(方括号内物质),能够使溶液恢复到原来的成分和浓度的是()A.CuSO4[Cu(OH)2]B.NaOH[Na2O]C.KCl[KCl]D.KNO3(H2O)6.(双选)关于下列装置的描述正确的是()A.甲装置可用于电解精炼铜B.乙装置红墨水水柱两边液面变为左低右高C.丙装置中的交换膜为阳离子交换膜D.丁装置可达到保护铁闸门的作用7.锌铜原电池(如图)工作时,下列叙述正确的是()A.正极反应为Zn-2e-=Zn2+B.电池反应为Zn+Cu2+=Zn2++CuC.盐桥中的K+移向ZnSO4溶液D.在外电路中,电流从负极流向正极8.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O下列叙述不正确的是()A.放电时锌作负极B.充电时氢氧化铁被氧化C.放电时溶液的碱性增强D.放电时转移3mole−,有2molFeO2−4被还原9.(双选)某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是()3Zn(OH)2+2Fe(OH)3+4KOH。A.电子通过外电路从a极流向b极B.b极上的电极反应式为:O2+2H2O+4e−=4OH−C.每转移0.1mol电子,消耗1.12L的H2D.H+由a极通过固体酸电解质传递到b极10.下列有关金属腐蚀与防护的说法中正确的是()A.在生产生活中比较普遍而且危害较大的是金属的化学腐蚀B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀11.用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是()A.通电后阴极区附近溶液pH会增大C.纯净的KOH溶液从b出口导出B.阳极反应式为4OH−-4e−=2H2O+O2↑D.K+通过交换膜从阴极区移向阳极区12.(双选)镁电池毒性低、污染小,电压高而平稳,逐渐成为人们研制绿色电池的关注焦点。其中一种镁电池的反应原理为:xMg+Mo3S4放电充电MgxMo3S4,下列错误的是()..A.放电时,正极反应式:Mo3S4+2xe−=Mo3S4B.充电时,阴极反应式:xMg2++2xe−=xMgC.放电时,Mo3S4发生氧化反应D.充电时,Mg2+向阳极迁移13.NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:2x-下列说法错误的是()A.NaClO2中Cl的化合价为+3价B.“电解”所用食盐水是由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为NaOH溶液、Na2CO3溶液C.“电解”中阴极反应的主要产物是NaClO2D.“尾气吸收”是吸收“电解”过程排出的少量ClO2,此吸收反应中,氧化剂与还原剂的物质的量之比为1∶214.(双选)光电池在光照条件下可产生电压,如图所示装置可实现光能的充分利用。双极膜复合层间的H2O能解离为H+和OH−,且双极膜能实现H+和OH−的定向通过。下列说法正确的是()A.该装置将光能最终转化为电能B.再生池中的反应为2V2++2H2O=2V3++2OH−+H2↑C.当阳极生成33.6LO2(标况下)时,电路中转移电子数为6NAD.光照过程中阳极区溶液中的n(OH−)基本不变15.载人空间站为了实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家设计了一种装置(如图),实现了“太阳能→电能→化学能”转化,总反应方程式为2CO2=2CO+O2。关于该装置的下列说法错误的是()A.图中N型半导...