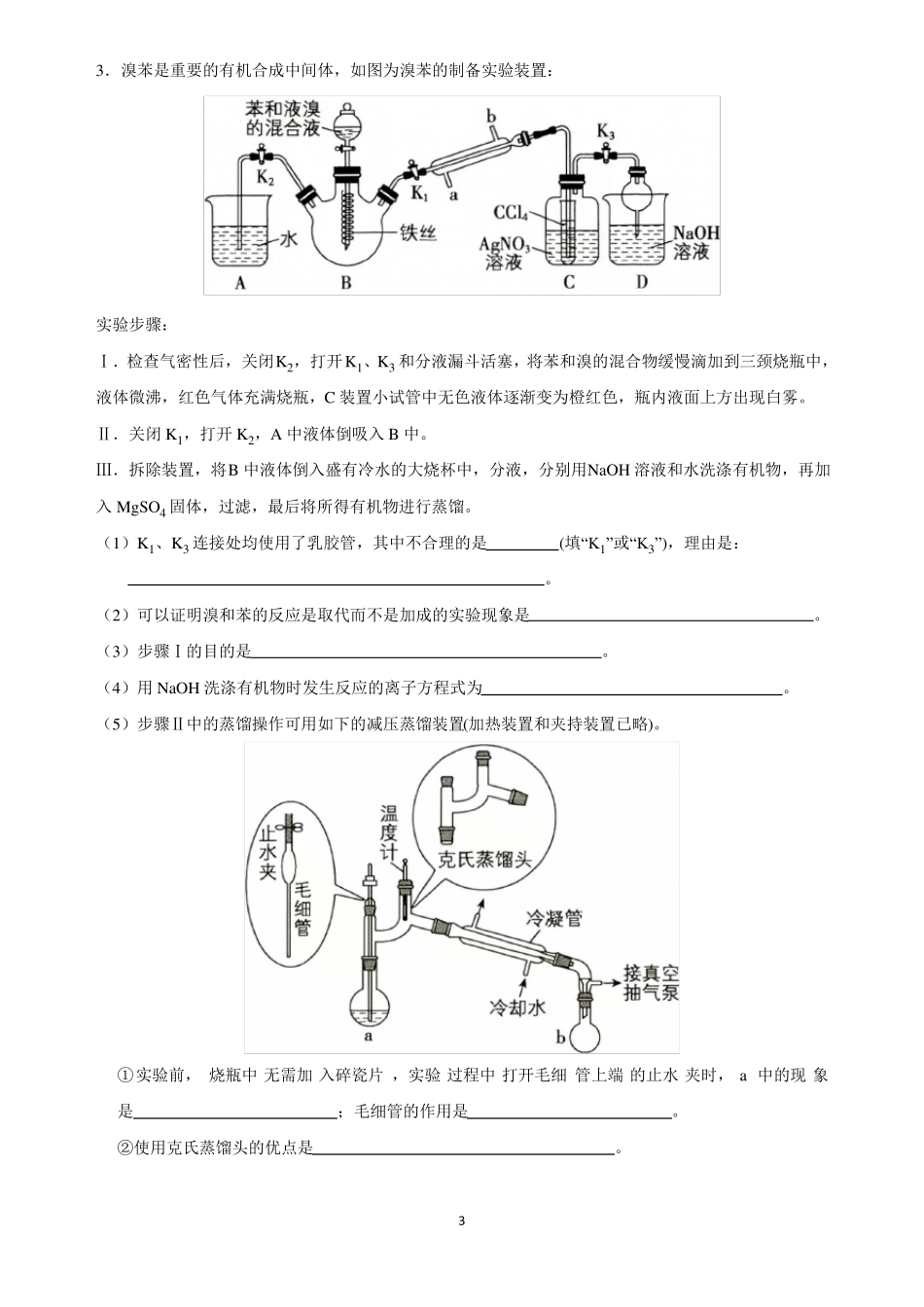
高考化学二轮复习:化学实验(大题)1.某兴趣小组设计实验探究SO2与新制Cu(OH)2悬浊液反应的产物。按图连接好装置(夹持装置省略),打开磁搅拌器,先往CuCl2溶液中加入NaOH溶液至恰好完全反应,再通入过量的SO2,三颈烧瓶中生成大量白色沉淀X。(1)制取SO2最适宜的试剂是。A.Na2SO3固体与20%的硝酸B.Na2SO3固体与20%的硫酸C.Na2SO3固体与70%的硫酸D.Na2SO3固体与18.4mol•L1的硫酸(2)根据选定的试剂,虚框中应选用(填“A”或“B”)装置;通入SO2过程中不断用磁搅拌器搅拌的目的是。(3)甲同学推测X可能为CuSO3。他取出少量洗涤后的X加入足量稀硫酸进行实验验证,观察到,则甲同学推测错误。(4)乙同学查阅资料:CuCl为白色固体,难溶于水,能溶于浓盐酸形成CuCl32;与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成深蓝色Cu(NH3)2+溶液。据此推测X可能为CuCl。他取出少量洗涤后的白色沉淀X,加入浓盐酸,沉淀溶解,加水稀释,又出现白色沉淀,据此得出乙同学推测正确。①从平衡角度解释加水稀释重新产生白色沉淀的原因。②请再设计一种证明该白色沉淀为CuCl的方案:。③三颈烧瓶中生成CuCl的离子方程式为:。1−−2.碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H4•H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH→N2H4•H2O+NaCl+Na2CO3①制取次氯酸钠和氢氧化钠混合液的连接顺序为(按气流方向,用小写字母表示)。−−若该实验温度控制不当,反应后测得三颈瓶内ClO与ClO3的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为。②制备水合肼时,应将滴到中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图2所示:在“还原”过程中,主要消耗反应过程中生成的副产物IO3,该过程的离子方程式为。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是。(3)测定产品中NaI含量的实验步骤如下:a.称取10.00g样品并溶解,在500mL容量瓶中定容;b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂;c.用0.2100mol•L1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。①M为(写名称)。②该样品中NaI的质量分数为。2−−3.溴苯是重要的有机合成中间体,如图为溴苯的制备实验装置:实验步骤:Ⅰ.检查气密性后,关闭K2,打开K1、K3和分液漏斗活塞,将苯和溴的混合物缓慢滴加到三颈烧瓶中,液体微沸,红色气体充满烧瓶,C装置小试管中无色液体逐渐变为橙红色,瓶内液面上方出现白雾。Ⅱ.关闭K1,打开K2,A中液体倒吸入B中。Ⅲ.拆除装置,将B中液体倒入盛有冷水的大烧杯中,分液,分别用NaOH溶液和水洗涤有机物,再加入MgSO4固体,过滤,最后将所得有机物进行蒸馏。(1)K1、K3连接处均使用了乳胶管,其中不合理的是(填“K1”或“K3”),理由是:。(2)可以证明溴和苯的反应是取代而不是加成的实验现象是。(3)步骤Ⅰ的目的是。(4)用NaOH洗涤有机物时发生反应的离子方程式为。(5)步骤Ⅱ中的蒸馏操作可用如下的减压蒸馏装置(加热装置和夹持装置已略)。①实验前,烧瓶中无需加入碎瓷片,实验过程中打开毛细管上端的止水夹时,a中的现象是;毛细管的作用是。②使用克氏蒸馏头的优点是。34.碘元素是人体的必需微量元素之一。某学习小组在实验室进行海带提碘的探究,实验过程如下:Ⅰ.海带中碘元素的确定(1)取海带灰浸取液1~2mL,加入稀硫酸约0.5mL、5%的H2O2溶液约0.5mL,然后加入CCl4约0.5mL,振荡后静置,可以观察到,证明海带中含有碘元素,该反应的离子方程式为。Ⅱ.海带提碘(2)若向100mL碘水L中加入20mLCCl4,充分振荡、静置,此时碘在CCl4中的物质的量浓度是水中的86倍,则萃取效率为%(结果保留小数点后两位)(3)萃取实验中,若要使碘尽可能地完全转移到CCl4中,可以采取的操...