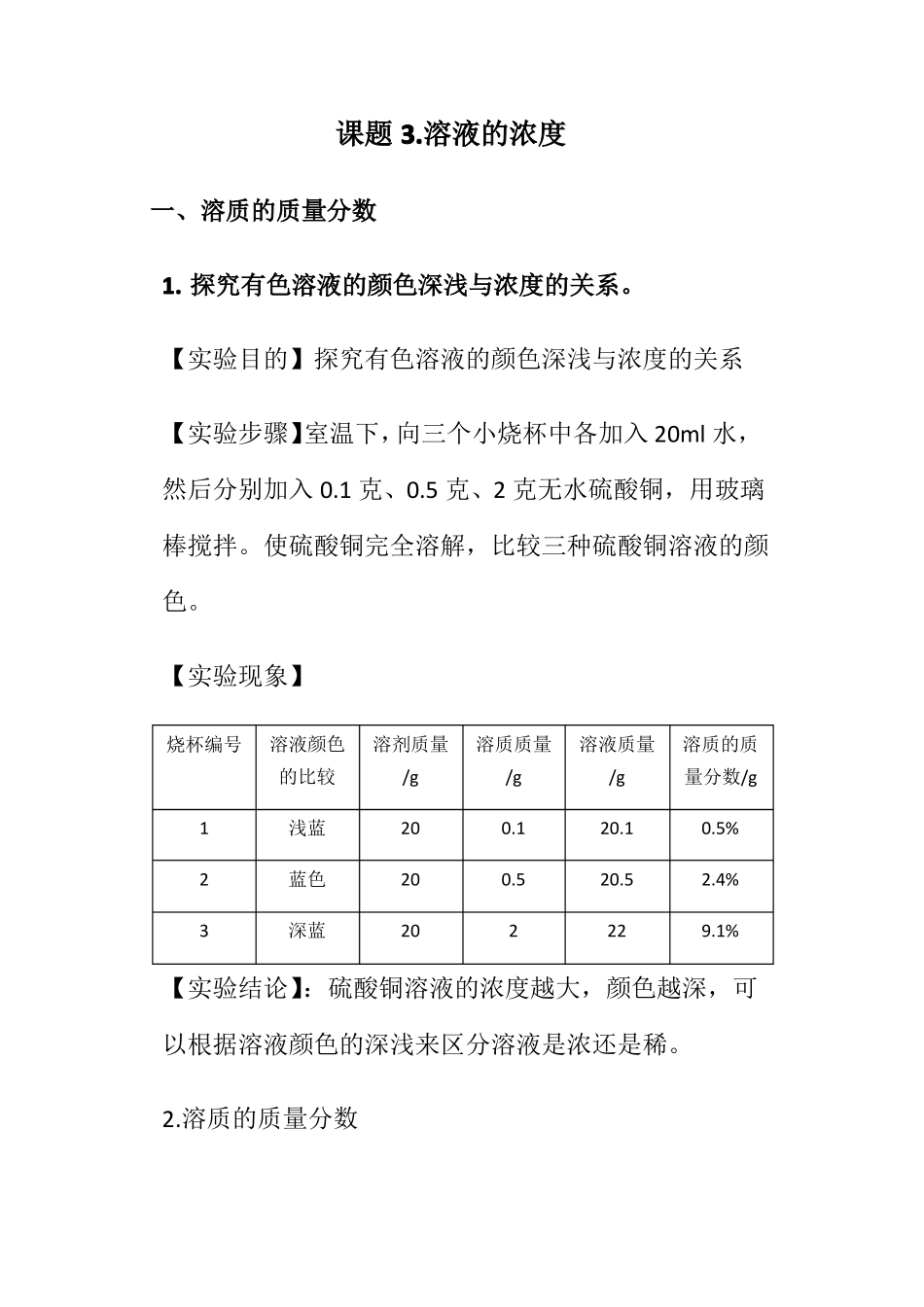
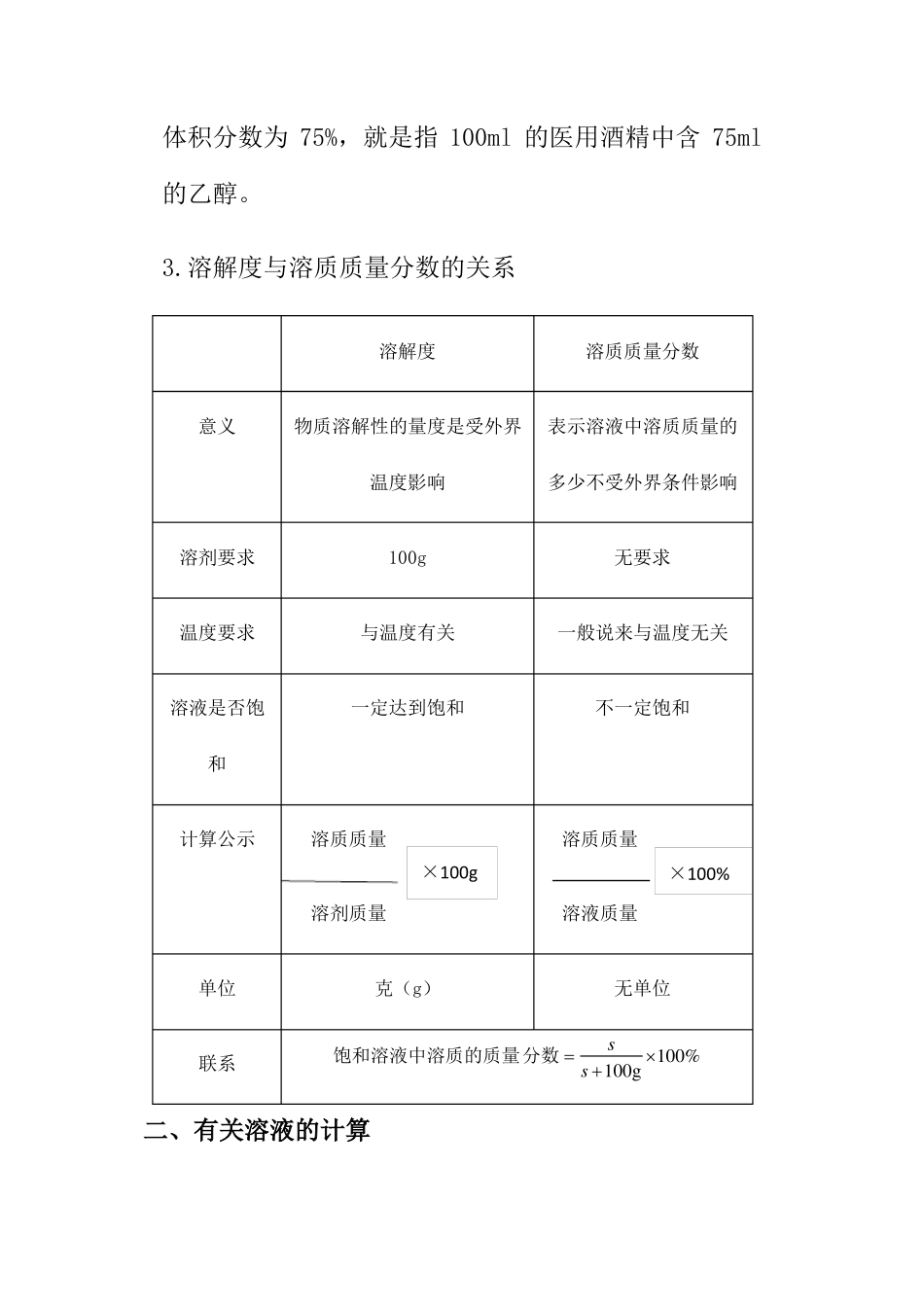
课题3.溶液的浓度一、溶质的质量分数1.探究有色溶液的颜色深浅与浓度的关系。【实验目的】探究有色溶液的颜色深浅与浓度的关系【实验步骤】室温下,向三个小烧杯中各加入20ml水,然后分别加入0.1克、0.5克、2克无水硫酸铜,用玻璃棒搅拌。使硫酸铜完全溶解,比较三种硫酸铜溶液的颜色。【实验现象】烧杯编号溶液颜色的比较123浅蓝蓝色深蓝溶剂质量/g202020溶质质量/g0.10.52溶液质量/g20.120.522溶质的质量分数/g0.5%2.4%9.1%【实验结论】:硫酸铜溶液的浓度越大,颜色越深,可以根据溶液颜色的深浅来区分溶液是浓还是稀。2.溶质的质量分数(1)定义:溶质的质量分数就是溶质的质量与溶液质量之比(2)公式:溶质质量溶质质量溶质质量100%溶质质量溶质的质量分数溶质的质量分数100%100100%%溶液质量溶质质量溶剂质量溶液质量溶质质量溶剂质量可变形为:溶质的质量=溶液的质量×溶质的质量分数溶质质量溶液的质量=溶质的质量分数饱和溶液中溶质的质量分数s100%s100g注意:①这里的溶质质量指的是溶解在溶液里的溶质质量不包括未溶解或者结晶析出的溶质的质量。②代入公式计算的一定是质量,必要时用密度公式换算成质量③一定温度下饱和溶液的溶质的质量分数最大。④除质量分数以外,人们有时也用体积分数来表示溶液的浓度。例如:用做消毒剂的医用酒精中乙醇的体积分数为75%,就是指100ml的医用酒精中含75ml的乙醇。3.溶解度与溶质质量分数的关系溶解度溶质质量分数意义物质溶解性的量度是受外界温度影响表示溶液中溶质质量的多少不受外界条件影响溶剂要求100g无要求温度要求与温度有关一般说来与温度无关溶液是否饱和一定达到饱和不一定饱和计算公示溶质质量×100g溶剂质量溶质质量×100%溶液质量单位克(g)无单位s100%s100g联系饱和溶液中溶质的质量分数二、有关溶液的计算1.溶液的稀释(1)计算依据:稀释前后溶液中溶质的质量不变(2)稀释方法:加溶剂稀释或加稀溶液稀释(3)关系式:加水稀释:m浓×a%=(m浓+m水)×b%稀加稀溶液稀释:m浓×a%浓+m稀×b%稀=(m浓+m稀)×c%(表示稀释后溶液中溶质的质量分数)2.溶液的增浓(1)增加溶质(注意:温度不变,向饱和溶液中增加溶质,溶质的质量分数不变)原溶液中的溶质与后加入的溶质质量之和等于混合后溶液中溶质的质量,即:原溶液中溶质的质量+增加的溶=混合后溶液中溶质的质量溶液的质量=原溶液的质量+增加的溶质的质量即若:设原溶液的质量为Ag,溶液质量分数为a%,加溶质为Bg后,变成溶质质量分数为b%的溶液,即:Ag×a%+Bg=(Ag+Bg)×b%(2)蒸发溶剂(无晶体析出)根据溶液蒸发溶剂后,溶质的质量不变。若设原溶液质量为Ag,溶质质量分数为a%,蒸发掉Bg水后,变成质量分数为b%的溶液,即:Ag×a%=(Ag-Bg)×b%(3)加入浓溶液根据混合后溶液的总质量等于两溶液的质量之和;混合后的溶液中溶质质量等于两溶液的溶质质量之和,若设原溶液质量为Ag,溶质质量分数为a%,浓溶液质量为Bg溶质质量分数为b%,两溶液混合后,得到溶质质量分数为c%的溶液,即:Ag×a%+Bg×b%=(Ag+Bg)×c%3.化学方程式与溶质质量分数的综合计算(1)在根据化学方程式列有关反应物、生成物的质量比时,要以溶质的质量列比例而不能用溶液的质量或体积。(2)对于反应后的所得溶液的质量有两种求法①溶液组成法:溶液质量=溶质质量+溶剂质量。注意:其中溶剂(水)的质量在计算中在不生成水的反应中,溶剂(水)的质量等于参加反应的各溶液中溶剂质量之和;若反应后有水生成,则,溶剂的质量还需加上生成的水的质量。②质量守恒法:溶液质量=反应物的质量总和-生成气体的质量-生成沉淀的质量三、溶液的配制(一)配制50g溶质质量分数为6%的NaCl溶液1.实验用品:托盘天平、烧杯、玻璃棒、药匙、氯化钠、量筒(10ml、50ml)胶头滴管2实验步骤:(1)计算:所需要的NaCl的质量为:50g×6%=3g,所需水的质量为:50g-3g=47g。(2)称量:用托盘天平称量3gNaCl,倒入烧杯中。(量取时注意,易潮解或易腐蚀的药品NaCl应放在玻璃器皿中,不要放在纸上)。(3)量取:把水的密度近似看作1g/cm3用50ml的量...