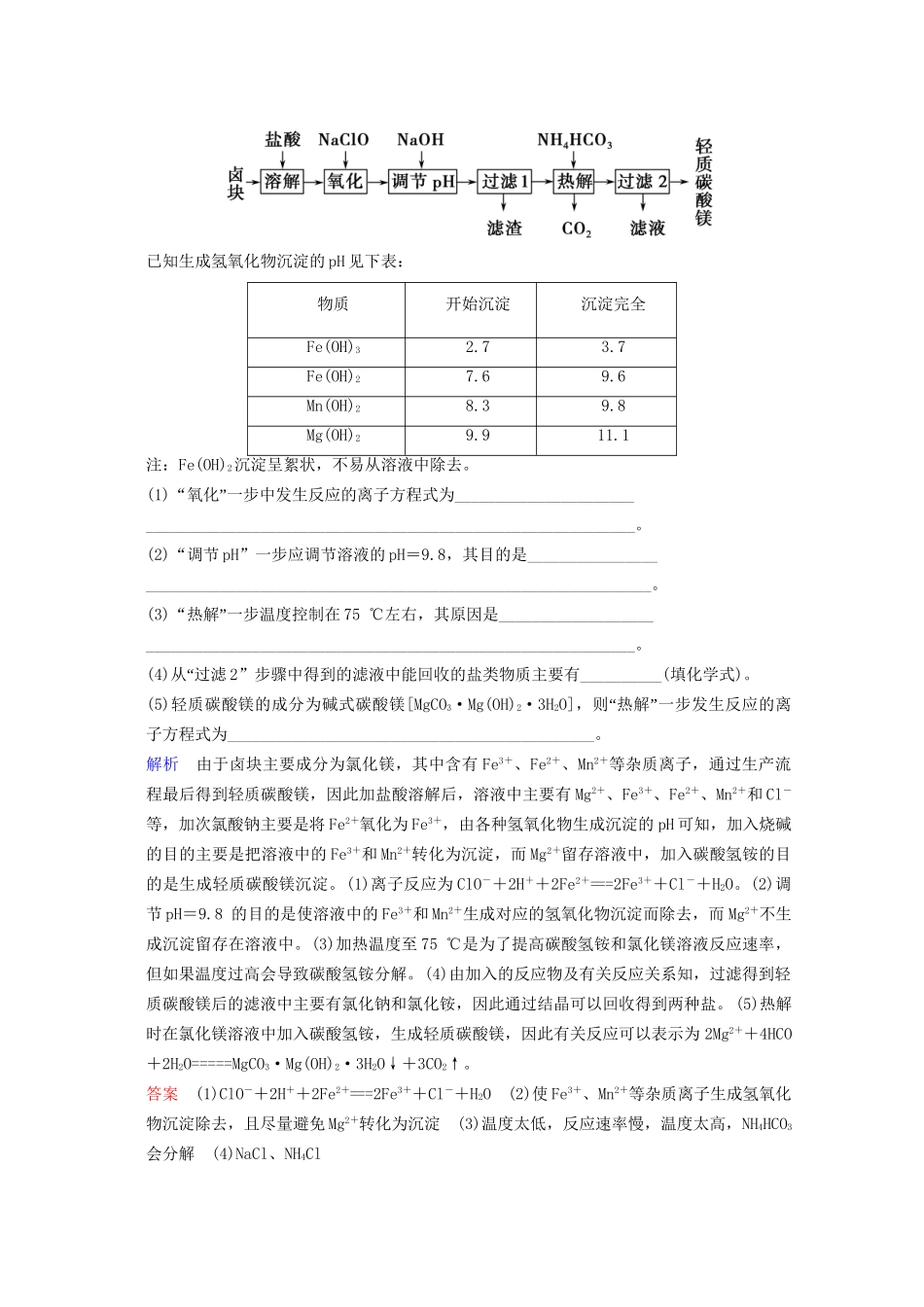
【创新设计】(江苏专用)高考化学二轮题型专攻微题型14无机化学工艺流程题(含新题,含解析)[题型专练]1.氯化铁是常见的水处理剂,无水FeCl3的熔点为555K,沸点为588K。工业上制备无水FeCl3的一种工艺流程如下:(1)氯化铁能用作水处理剂的原因是__________________________________(用必要的文字和化学方程式说明)。(2)吸收塔中吸收剂X是________________________,有关反应的离子方程式是________________________。(3)温度超过673K时,捕集器中捕集到的物质的相对分子质量为325,该物质的分子式为________________。(4)从副产物FeCl3溶液中获得FeCl3·6H2O的方法是_______________________。(5)用FeCl3溶液(32%~35%)腐蚀印刷线路板的废液中含FeCl3、FeCl2和CuCl2。用化学方法回收废液中铜的方法是__________________________(用反应式表示并简述操作要点)。解析(1)FeCl3是强酸弱碱盐,能水解生成Fe(OH)3胶体,Fe(OH)3胶体可吸附并沉降水中悬浮的杂质,用作净水剂。(2)铁屑与氯气在反应炉中发生放热反应,反应炉中的温度很高,所以尾气中含有Cl2和FeCl3,用吸收剂FeCl2溶液可吸收此尾气得到FeCl3溶液。(3)FeCl3的相对分子质量为162.5,所以捕集器中相对分子质量为325的物质为Fe2Cl6。(4)FeCl3水解生成的HCl易挥发,直接在空气中加热FeCl3溶液不能得到FeCl3·6H2O,为了抑制FeCl3水解,可在HCl气氛中加热浓缩FeCl3溶液,然后冷却结晶。答案(1)FeCl3+3H2OFe(OH)3(胶体)+3HCl,Fe(OH)3胶体能吸附并沉降水中悬浮的物质(2)FeCl2溶液2Fe2++Cl2===2Fe3++2Cl-(3)Fe2Cl6(4)在HCl气氛中加热浓缩FeCl3溶液,然后冷却结晶(5)加过量铁粉,发生反应CuCl2+Fe===FeCl2+Cu,过滤,分离得到的固体再与盐酸反应以溶解残留的铁,过滤得到铜(或过滤、洗涤、干燥后,用磁铁吸去铁可得到铜)2.轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,以卤块(主要成分为MgCl2,含Fe2+、Fe3+、Mn2+等杂质离子)为原料制备轻质碳酸镁的工艺流程如下:已知生成氢氧化物沉淀的pH见下表:物质开始沉淀沉淀完全Fe(OH)32.73.7Fe(OH)27.69.6Mn(OH)28.39.8Mg(OH)29.911.1注:Fe(OH)2沉淀呈絮状,不易从溶液中除去。(1)“”氧化一步中发生反应的离子方程式为__________________________________________________________________________________。(2)“调节pH”一步应调节溶液的pH=9.8,其目的是______________________________________________________________________________。(3)“”热解一步温度控制在75℃左右,其原因是_______________________________________________________________________________。(4)“从过滤2”步骤中得到的滤液中能回收的盐类物质主要有__________(填化学式)。(5)轻质碳酸镁的成分为碱式碳酸镁[MgCO3·Mg(OH)2·3H2O]“”,则热解一步发生反应的离子方程式为_____________________________________________。解析由于卤块主要成分为氯化镁,其中含有Fe3+、Fe2+、Mn2+等杂质离子,通过生产流程最后得到轻质碳酸镁,因此加盐酸溶解后,溶液中主要有Mg2+、Fe3+、Fe2+、Mn2+和Cl-等,加次氯酸钠主要是将Fe2+氧化为Fe3+,由各种氢氧化物生成沉淀的pH可知,加入烧碱的目的主要是把溶液中的Fe3+和Mn2+转化为沉淀,而Mg2+留存溶液中,加入碳酸氢铵的目的是生成轻质碳酸镁沉淀。(1)离子反应为ClO-+2H++2Fe2+===2Fe3++Cl-+H2O。(2)调节pH=9.8的目的是使溶液中的Fe3+和Mn2+生成对应的氢氧化物沉淀而除去,而Mg2+不生成沉淀留存在溶液中。(3)加热温度至75℃是为了提高碳酸氢铵和氯化镁溶液反应速率,但如果温度过高会导致碳酸氢铵分解。(4)由加入的反应物及有关反应关系知,过滤得到轻质碳酸镁后的滤液中主要有氯化钠和氯化铵,因此通过结晶可以回收得到两种盐。(5)热解时在氯化镁溶液中加入碳酸氢铵,生成轻质碳酸镁,因此有关反应可以表示为2Mg2++4HCO+2H2O=====MgCO3·Mg(OH)2·3H2O↓+3CO2↑。答案(1)ClO-+2H++2Fe2+===2Fe3++Cl-+H2O(2)使Fe3+、Mn2+等杂质离子生成氢氧化物沉淀除去,且尽量避免Mg2+转化为沉淀(3)...