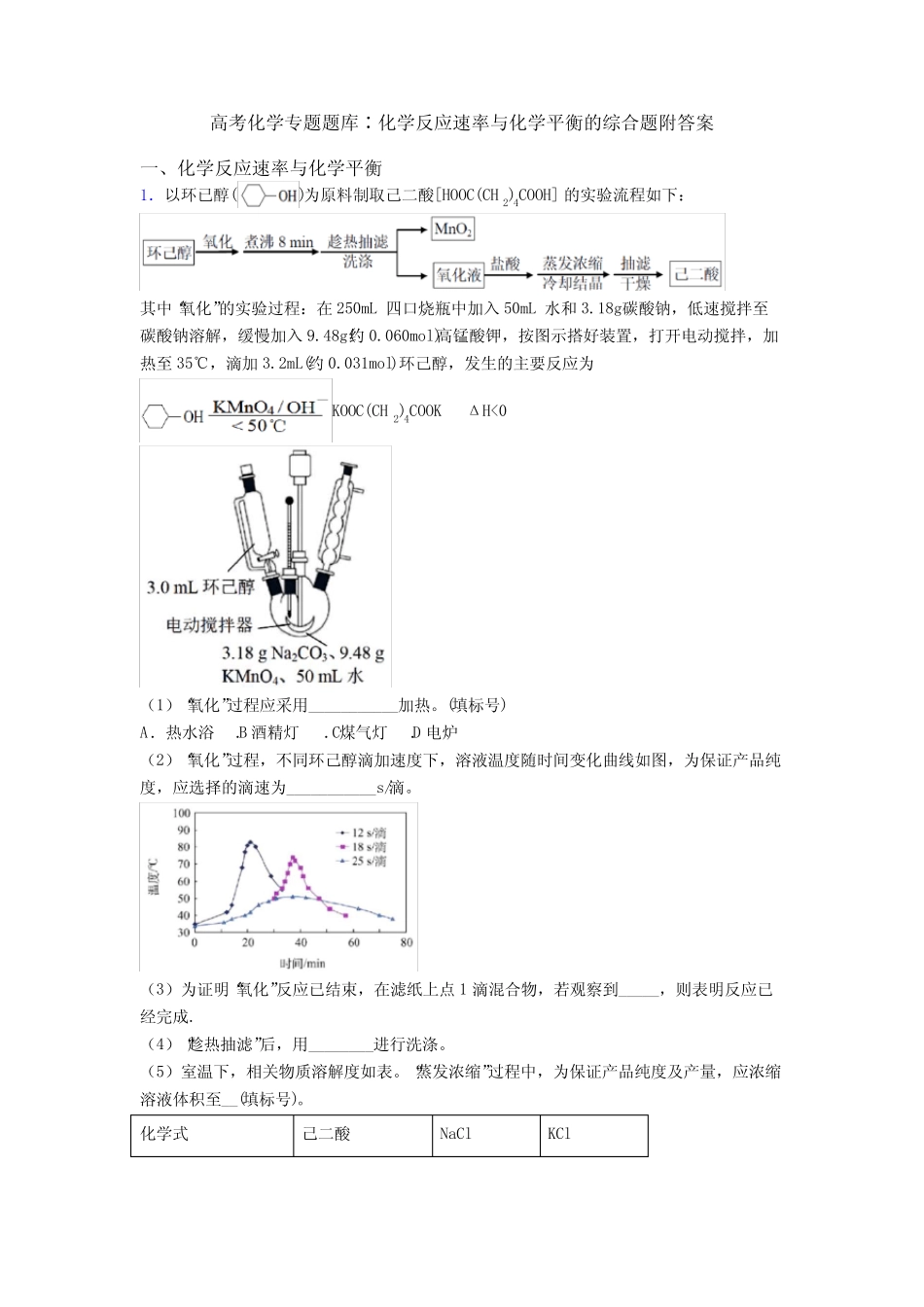
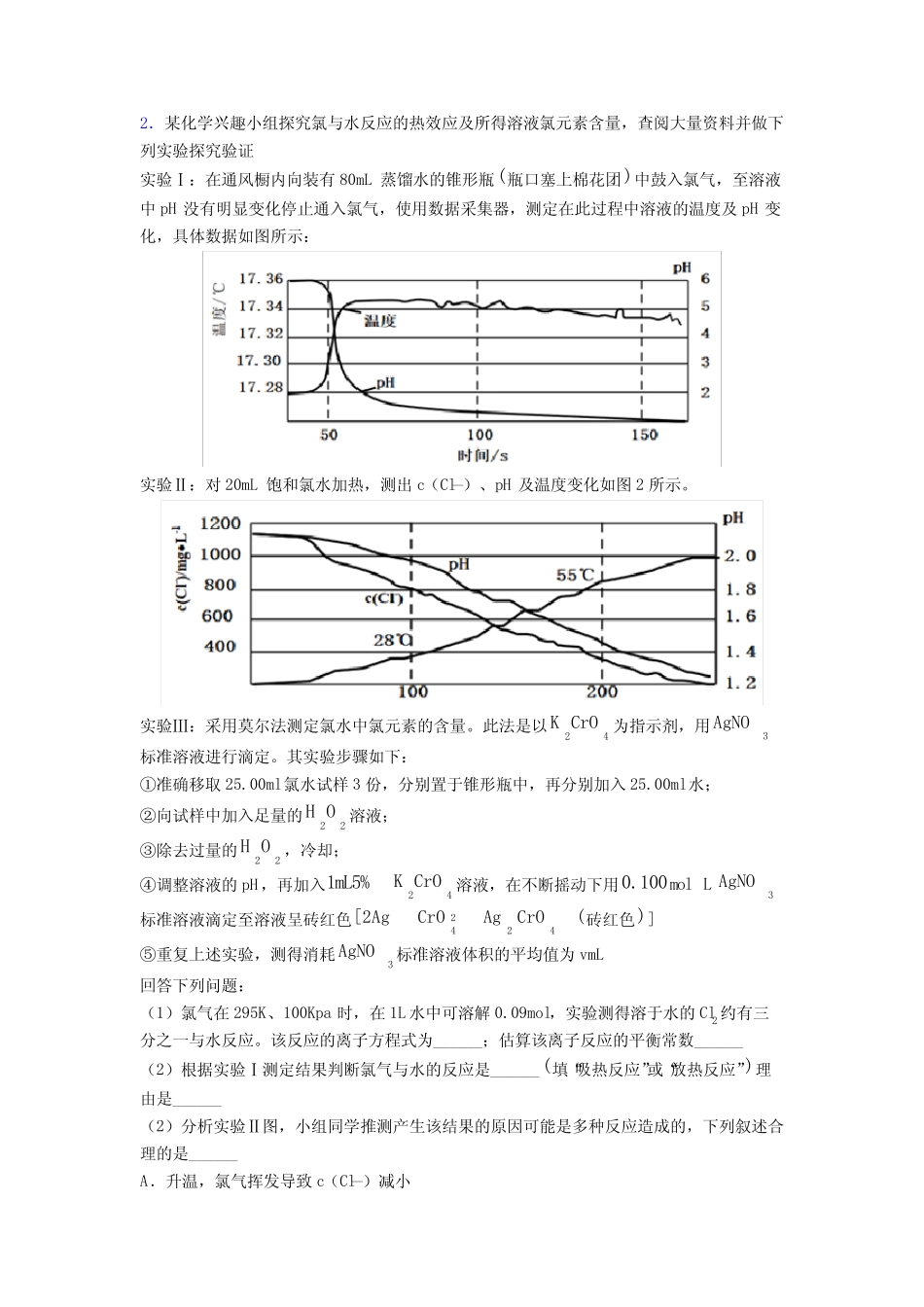
高考化学专题题库∶化学反应速率与化学平衡的综合题附答案一、化学反应速率与化学平衡1.以环已醇()为原料制取己二酸[HOOC(CH2)4COOH]的实验流程如下:其中“氧化”的实验过程:在250mL四口烧瓶中加入50mL水和3.18g碳酸钠,低速搅拌至碳酸钠溶解,缓慢加入9.48g(约0.060mol)高锰酸钾,按图示搭好装置,打开电动搅拌,加热至35℃,滴加3.2mL(约0.031mol)环己醇,发生的主要反应为KOOC(CH2)4COOKΔH<0(1)“氧化”过程应采用___________加热。(填标号)A.热水浴B.酒精灯C.煤气灯D.电炉(2)“氧化”过程,不同环己醇滴加速度下,溶液温度随时间变化曲线如图,为保证产品纯度,应选择的滴速为___________s/滴。(3)为证明“氧化”反应已结束,在滤纸上点1滴混合物,若观察到_____,则表明反应已经完成.(4)“趁热抽滤”后,用________进行洗涤。(5)室温下,相关物质溶解度如表。“蒸发浓缩”过程中,为保证产品纯度及产量,应浓缩溶液体积至__(填标号)。化学式己二酸NaClKCl溶解度g/100g水1.4435.133.3A.5mLB.10mLC.15mLD.20mL(6)称取已二酸(Mr=146g/mol)样品0.2920g,用新煮沸的50mL热水溶解,滴入2滴酚酞试液,用0.2000mol/LNaOH溶液滴定至终点,进行平行实验及空白实验后,消耗NaOH的平均体积为19.70mL.①NaOH溶液应装于_______(填仪器名称).②己二酸样品的纯度为___________.【答案】A25未出现紫红色热水C碱性滴定管98.5%【解析】【详解】(1)由题可知,“氧化”过程中反应温度为35℃,因此应采用热水浴加热,故答案为:A;(2)为保证反应温度的稳定性(小于50℃),由图可知,最好采用25s/滴,故答案为:25;(3)0.031mol环己醇完全氧化为KOOC(CH2)4COOK,失去电子0.031mol×8=0.248mol,而0.06mol高锰酸钾在碱性条件下完全反应转移电子0.18mol(KMnO4→MnO2),由此可知,高锰酸钾先消耗完,若证明“氧化”反应已结束,在滤纸上点1滴混合物,若观察到未出现紫红色,则说明已经完成,故答案为:未出现紫红色;(4)趁热抽滤后,应用热水进行洗涤,故答案为:热水;(5)溶液中杂质KCl的质量为:0.06mol×(39+35.5)g/mol=4.47g,完全溶解KCl所需水的体积为:4.4710033.3mL=13.42mL,当杂质全部溶解在水中时,己二酸能够最大限度析出,故应浓缩溶液体积至15mL,故答案为:C;(6)NaOH溶液应装于碱式滴定管;由HOOC(CH2)4COOH+2NaOH=2H2O+NaOOC(CH2)4COONa可知,n(NaOH)=12n(HOOC(CH2)4COOH),故己二酸样品的纯度为-319.710L0.2mol/L146g/mol0.5100%2.92g=98.5%,故答案为:碱式滴定管;98.5%。【点睛】对于本题第(5)问解答过程中需注意,进行重结晶的试验中,对所需产品的析出纯度要求较高时,杂质最好全部溶解在水中,若杂质随产品一起析出,将会降低产品的纯度。2.某化学兴趣小组探究氯与水反应的热效应及所得溶液氯元素含量,查阅大量资料并做下列实验探究验证实验Ⅰ:在通风橱内向装有80mL蒸馏水的锥形瓶(瓶口塞上棉花团)中鼓入氯气,至溶液中pH没有明显变化停止通入氯气,使用数据采集器,测定在此过程中溶液的温度及pH变化,具体数据如图所示:实验Ⅱ:对20mL饱和氯水加热,测出c(Cl—)、pH及温度变化如图2所示。实验Ⅲ:采用莫尔法测定氯水中氯元素的含量。此法是以24KCrO为指示剂,用3AgNO标准溶液进行滴定。其实验步骤如下:①准确移取25.00ml氯水试样3份,分别置于锥形瓶中,再分别加入25.00ml水;②向试样中加入足量的22HO溶液;③除去过量的22HO,冷却;④调整溶液的pH,再加入1mL5%24KCrO溶液,在不断摇动下用0.100molL3AgNO标准溶液滴定至溶液呈砖红色242[2AgCrOAg4CrO(砖红色)]⑤重复上述实验,测得消耗3AgNO标准溶液体积的平均值为vmL回答下列问题:(1)氯气在295K、100Kpa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。该反应的离子方程式为______;估算该离子反应的平衡常数______(2)根据实验Ⅰ测定结果判断氯气与水的反应是______(填“吸热反应”或“放热反应”)理由是______(2)分析实验Ⅱ图,小组同学推测产生该结果的原因可能是多种反应造成的,下列叙述合理的是______A.升温...