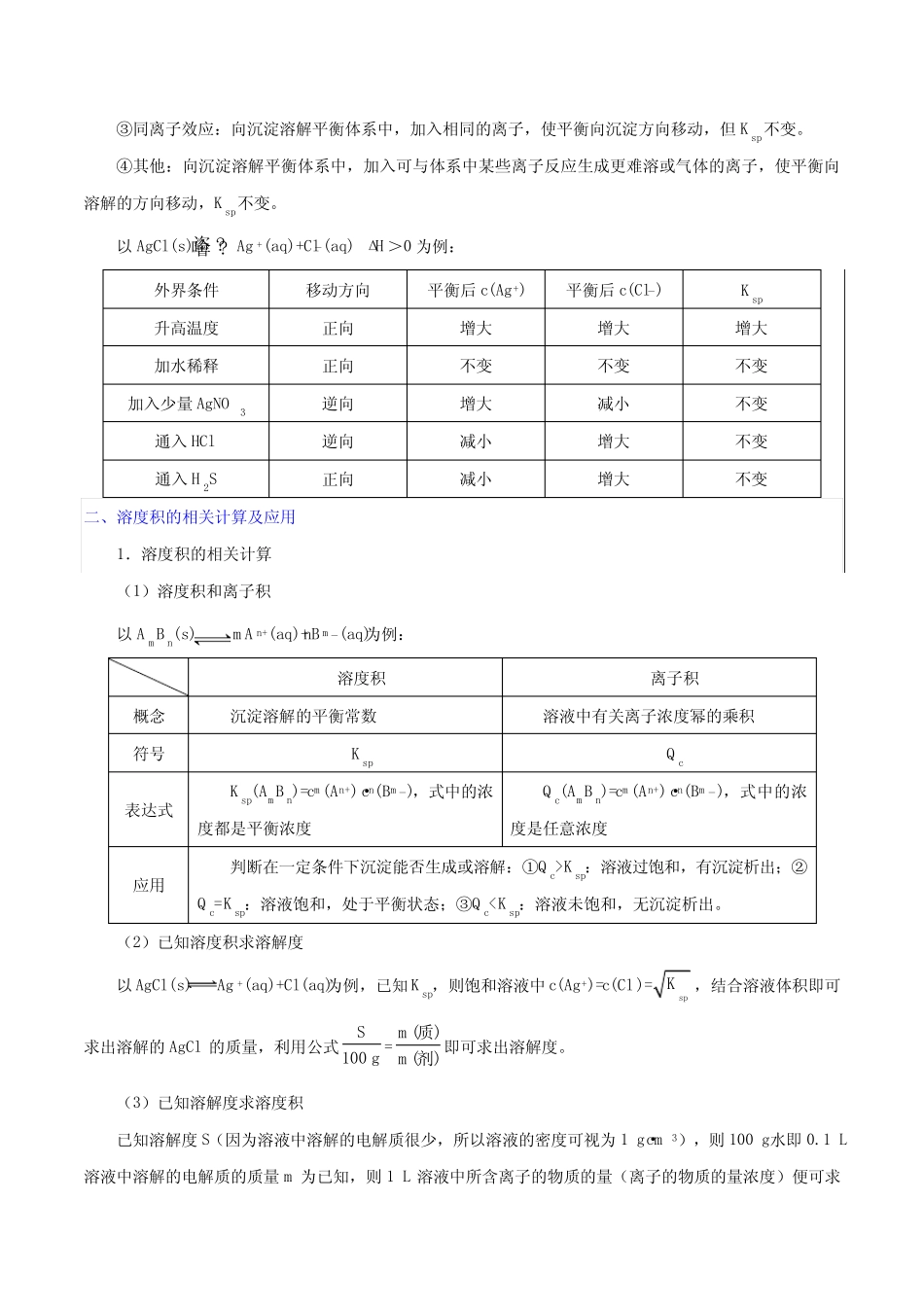
一、沉淀溶解平衡及其影响因素1.沉淀溶解平衡的概念在一定温度下,当难溶强电解质溶于水形成饱和溶液时,溶解速率和生成沉淀的速率相等的状态。2.沉淀溶解平衡的建立3.沉淀溶解平衡的特征4.影响沉淀溶解平衡的因素(1)内因难溶电解质本身的性质。(2)外因①浓度:加水稀释,沉淀溶解平衡向溶解的方向移动,但Ksp不变。②温度:多数难溶电解质的溶解过程是吸热的,所以升高温度,沉淀溶解平衡向溶解的方向移动,同时Ksp变大。③同离子效应:向沉淀溶解平衡体系中,加入相同的离子,使平衡向沉淀方向移动,但Ksp不变。④其他:向沉淀溶解平衡体系中,加入可与体系中某些离子反应生成更难溶或气体的离子,使平衡向溶解的方向移动,Ksp不变。以AgCl(s)垐?噲?Ag+(aq)+Cl-(aq)ΔH>0为例:外界条件移动方向平衡后c(Ag+)平衡后c(Cl-)Ksp升高温度正向增大增大增大加水稀释正向不变不变不变加入少量AgNO3逆向增大减小不变通入HCl逆向减小增大不变通入H2S正向减小增大不变二、溶度积的相关计算及应用1.溶度积的相关计算(1)溶度积和离子积以AmBn(s)mAn+(aq)+nBm-(aq)为例:溶度积离子积概念沉淀溶解的平衡常数溶液中有关离子浓度幂的乘积符号KspQc表达式Ksp(AmBn)=cm(An+)·cn(Bm-),式中的浓度都是平衡浓度Qc(AmBn)=cm(An+)·cn(Bm-),式中的浓度是任意浓度应用判断在一定条件下沉淀能否生成或溶解:①Qc>Ksp:溶液过饱和,有沉淀析出;②Qc=Ksp:溶液饱和,处于平衡状态;③Qc