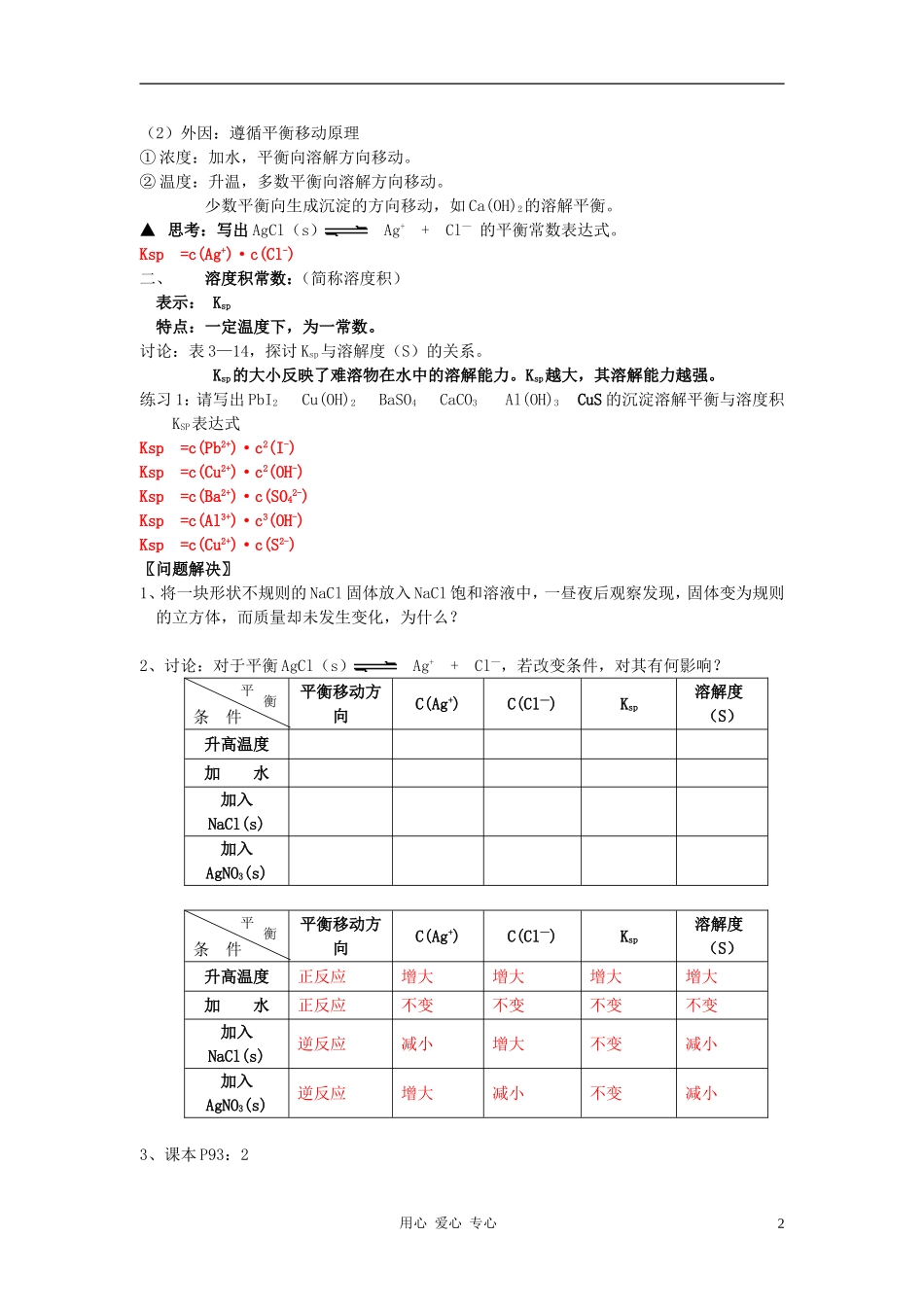
第1课时沉淀溶解平衡原理教学设计【教学过程】引言:某温度下,溶质B的饱和溶液——不能再溶解溶质B的溶液可计算出溶质B在该温度下的溶解度(S)难溶微溶易溶0.010.1m(g)因而,难溶只是指其溶解度很小,而非绝对不溶。思考:10mL0.1mol/LAgNO3和11mL0.1mol/LNaCl完合混合后,溶液中还有Ag+吗?如何证明?〖活动与探究〗实验过程现象解释与结论10mL1mol/LAgNO311mL1mol/LNaCl取上层清液适量,滴加少量KI溶液实验过程现象解释与结论10mL1mol/LAgNO311mL1mol/LNaCl产生白色沉淀Ag++Cl-=AgCl↓取上层清液适量,滴加少量KI溶液产生黄色沉淀说明溶液中还有少量的Ag+,Ag++I-=AgI↓一、沉淀溶解平衡:沉淀溶解过程——速率v1AgCl(s)Ag++Cl—沉淀生成过程——速率v2v1>v2——沉淀溶解——溶液不饱和v1=v2——溶解的沉淀=生成的沉淀——溶液饱和——处于平衡状态v1﹤v2——沉淀生成——溶液过饱和▲1、概念:一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成溶质的饱和溶液,达到平衡状态,人们将这种平衡称为沉淀溶解平衡。▲2、特点:逆:是一个可逆的过程等:v1=v2动:v1=v2≠0——动态平衡定:溶液中溶质的分子或离子的浓度不再变化。变:当条件改变时,溶质的溶解平衡可发生移动,达到新的平衡。▲3、影响沉淀溶解平衡的因素:(1)内因:溶质本身的性质绝对不溶的物质是没有的。同是难溶物质,溶解度差别也很大。易溶溶质只要是饱和溶液也可存在溶解平衡。用心爱心专心1(2)外因:遵循平衡移动原理①浓度:加水,平衡向溶解方向移动。②温度:升温,多数平衡向溶解方向移动。少数平衡向生成沉淀的方向移动,如Ca(OH)2的溶解平衡。▲思考:写出AgCl(s)Ag++Cl—的平衡常数表达式。Ksp=c(Ag+)·c(Cl-)二、溶度积常数:(简称溶度积)表示:Ksp特点:一定温度下,为一常数。讨论:表3—14,探讨Ksp与溶解度(S)的关系。Ksp的大小反映了难溶物在水中的溶解能力。Ksp越大,其溶解能力越强。练习1:请写出PbI2Cu(OH)2BaSO4CaCO3Al(OH)3CuS的沉淀溶解平衡与溶度积KSP表达式Ksp=c(Pb2+)·c2(I-)Ksp=c(Cu2+)·c2(OH-)Ksp=c(Ba2+)·c(SO42-)Ksp=c(Al3+)·c3(OH-)Ksp=c(Cu2+)·c(S2-)〖问题解决〗1、将一块形状不规则的NaCl固体放入NaCl饱和溶液中,一昼夜后观察发现,固体变为规则的立方体,而质量却未发生变化,为什么?2、讨论:对于平衡AgCl(s)Ag++Cl—,若改变条件,对其有何影响?条件平衡移动方向C(Ag+)C(Cl—)Ksp溶解度(S)升高温度加水加入NaCl(s)加入AgNO3(s)条件平衡移动方向C(Ag+)C(Cl—)Ksp溶解度(S)升高温度正反应增大增大增大增大加水正反应不变不变不变不变加入NaCl(s)逆反应减小增大不变减小加入AgNO3(s)逆反应增大减小不变减小3、课本P93:2用心爱心专心2平衡平衡用心爱心专心3