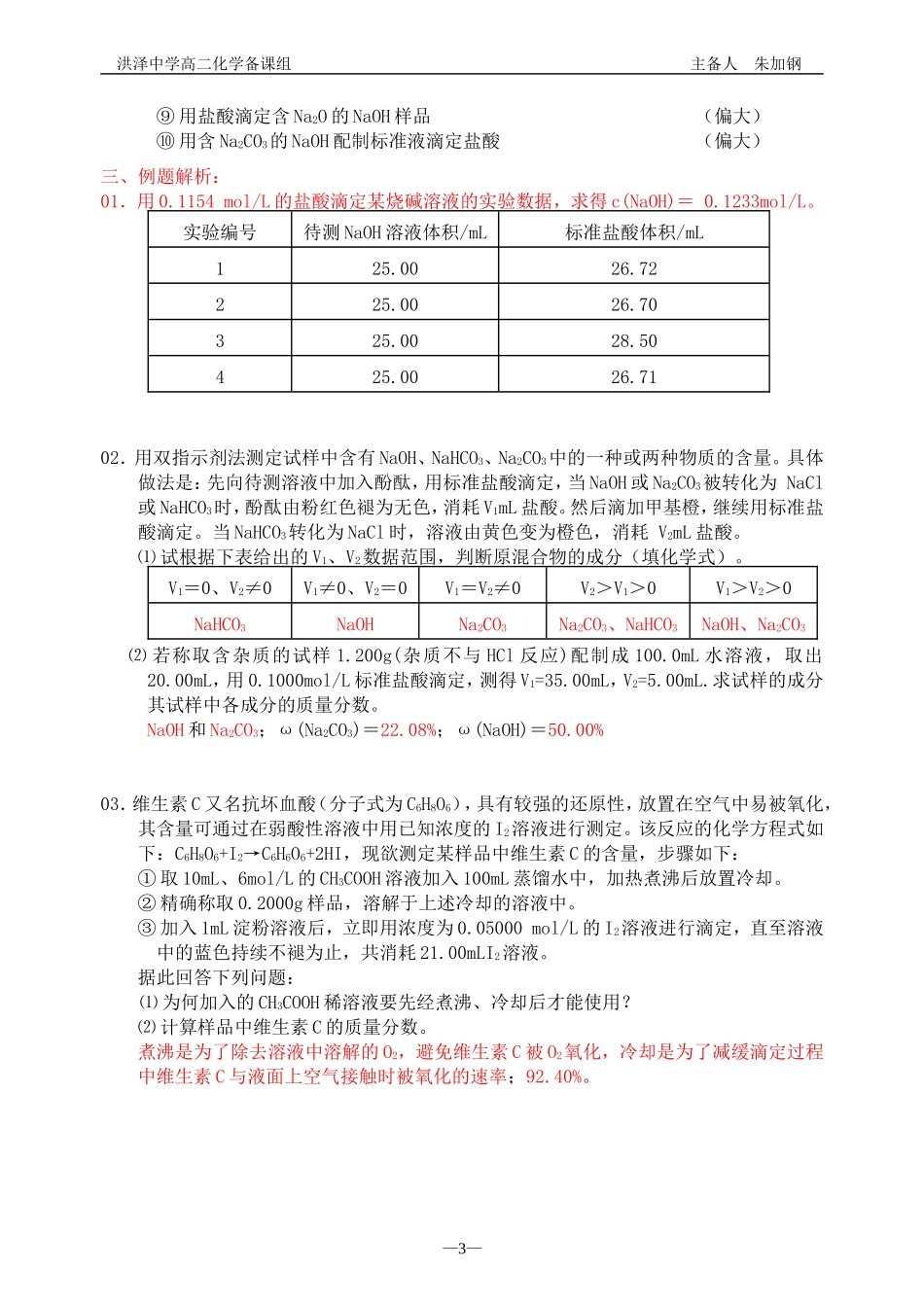
洪泽中学高二化学备课组主备人朱加钢【课题】中和滴定【教学目标】01.理解中和滴定原理02.掌握中和滴定操作【重点难点】01.中和滴定原理02.中和滴定操作【教学过程】一、中和滴定的原理分析:01.实例:用0.1000mol/LNaOH溶液滴定20.00mL、0.1000mol/LHCl溶液。02.分析:(通过计算绘制酸碱滴定曲线)⑴滴定前:c(H+)=0.1000mol/L,pH=1.0⑵从滴定开始到化学计量点之前:盐酸过量,c(H+)=c(HCl)·[V(HCl)-V(NaOH)]/[V(HCl)+V(NaOH)],其中,V(HCl)、V(NaOH)分别表示HCl溶液的总体积和加入的NaOH溶液的总体积。当滴入NaOH溶液19.96mL时(比化学计量点NaOH溶液少1滴):c(H+)=(20.00mL-19.96mL)×0.1000mol/L÷(20.00mL+19.96mL)=1.000×10-4mol/LpH=-lg(1.000×10-4)=4.0⑶化学计量点时:溶液呈中性,c(H+)=1.000×10-7mol/L,pH=7.0。⑷化学计量点后:NaOH过量,c(OH-)=c(NaOH)·[V(NaOH)-V(HCl)]/[V(HCl)+V(NaOH)],当滴入NaOH溶液20.04mL时(比化学计量点NaOH溶液多1滴):c(OH-)=(20.04mL-20.00mL)×0.1000mol/L÷(20.04mL+20.00mL)=1.000×10-4mol/LpOH=-lg(1.000×10-4)=4.0,pH=14.0-4.0=10.0。⑸突变范围:pH在4-10之间,表示这种突变的图示如下(虚线表示0.1000mol/LHCl滴定20.00mL、0.1000mol/LNaOH溶液时的突变)。—1—洪泽中学高二化学备课组主备人朱加钢⑹指示剂选择:强酸和强碱之间的滴定,在化学计量点(滴定终点)前后,溶液的pH会发生突变,这种突变对于选择合适的指示剂具有重要意义,只要变色范围在突变范围内的指示剂都可选择(一般从甲基橙、甲基红、酚酞中选择而不选石蕊)。⑺注意:酸、碱液的浓度越小,突变范围越小,选择的指示剂可能发生变化。例如:用0.1000mol/LNaOH溶液滴定0.1000mol/LHCl溶液:酚酞、甲基红、甲基橙;用0.01000mol/LNaOH溶液滴定0.01000mol/LHCl溶液(蓝线):酚酞、甲基红;用0.001000mol/LNaOH溶液滴定0.001000mol/LHCl溶液(红线):甲基红。⑻小结:酸碱滴定曲线以滴加酸液or碱液的量为横坐标,以溶液的pH为纵坐标,描述酸碱中和滴定过程中溶液pH的变化情况,其中滴定终点附近pH会发生突变,因此选择适当的指示剂就能准确判断滴定终点;另外,选择滴定管以精确测量放出的酸碱液体积,从而解决了中和滴定的两大难题。二、中和滴定的操作分析:01.操作程序:⑴洗涤;⑵检漏;⑶润洗;⑷装液并固定;⑸调节起始读数;⑹取待测液;⑺加指示剂;⑻滴定至终点后读末读数;⑼重复滴定操作;⑽数据处理。02.误差分析:⑴强滴强误差分析原理:标准液体积偏大,实验结果就偏大,反之,实验结果偏小。⑵误差分析训练:①盛标准液的滴定管用蒸馏水洗涤后未用标准液润洗(偏大)②滴定前仰视,滴定后俯视(偏小)③锥形瓶用蒸馏水洗后再用待测液润洗(偏大)④盛待测液的滴定管尖嘴部分有气泡,取用待测液后气泡消失(偏小)⑤滴定过程中,振荡锥形瓶时,不小心有液体溅出(偏小)⑥盛待测液的滴定管或移液管用蒸馏水洗涤后未用待测液润洗(偏小)⑦快速滴定后立即读数(偏大)⑧滴定管的尖嘴部分有一滴标准液未滴下(偏大)—2—洪泽中学高二化学备课组主备人朱加钢⑨用盐酸滴定含Na2O的NaOH样品(偏大)⑩用含Na2CO3的NaOH配制标准液滴定盐酸(偏大)三、例题解析:01.用0.1154mol/L的盐酸滴定某烧碱溶液的实验数据,求得c(NaOH)=0.1233mol/L。实验编号待测NaOH溶液体积/mL标准盐酸体积/mL125.0026.72225.0026.70325.0028.50425.0026.7102.用双指示剂法测定试样中含有NaOH、NaHCO3、Na2CO3中的一种或两种物质的含量。具体做法是:先向待测溶液中加入酚酞,用标准盐酸滴定,当NaOH或Na2CO3被转化为NaCl或NaHCO3时,酚酞由粉红色褪为无色,消耗V1mL盐酸。然后滴加甲基橙,继续用标准盐酸滴定。当NaHCO3转化为NaCl时,溶液由黄色变为橙色,消耗V2mL盐酸。⑴试根据下表给出的V1、V2数据范围,判断原混合物的成分(填化学式)。V1=0、V2≠0V1≠0、V2=0V1=V2≠0V2>V1>0V1>V2>0NaHCO3NaOHNa2CO3Na2CO3、NaHCO3NaOH、Na2CO3⑵若称取含杂质的试样1.200g(杂质不与HCl反应)配制成100.0mL水溶液,取出20.00mL,用0...