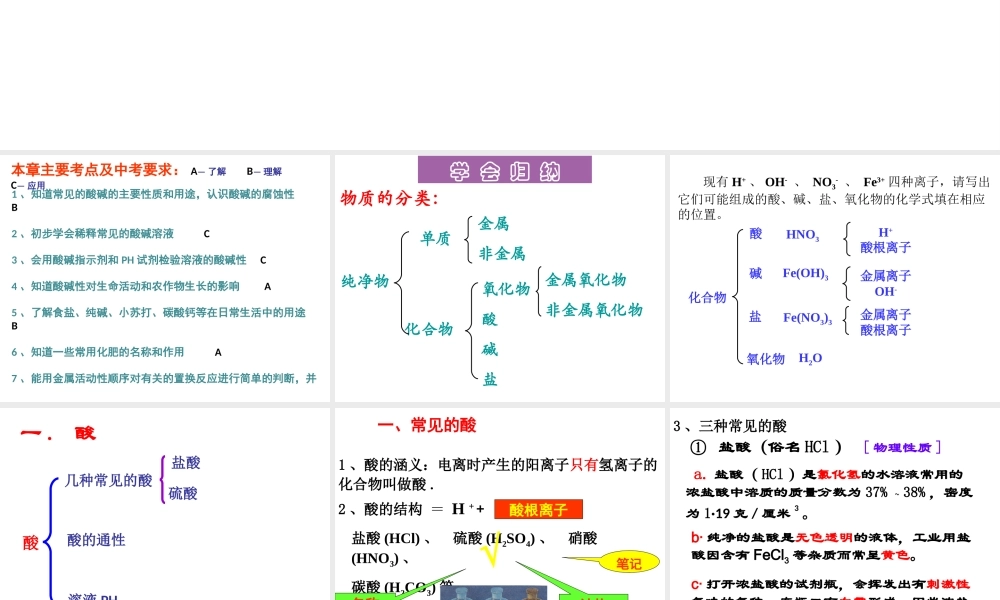
中考复习本章主要考点及中考要求: A— 了解 B— 理解 C— 应用1 、知道常见的酸碱的主要性质和用途,认识酸碱的腐蚀性 B2 、初步学会稀释常见的酸碱溶液 C3 、会用酸碱指示剂和 PH 试剂检验溶液的酸碱性 C4 、知道酸碱性对生命活动和农作物生长的影响 A5 、了解食盐、纯碱、小苏打、碳酸钙等在日常生活中的用途 B6 、知道一些常用化肥的名称和作用 A7 、能用金属活动性顺序对有关的置换反应进行简单的判断,并 能解释与日常生活中的一些现象 C学 会 归 纳化合物 金属非金属氧化物酸碱 盐金属氧化物非金属氧化物物质的分类:纯净物单质 现有 H+ 、 OH- 、 NO3- 、 Fe3+ 四种离子,请写出它们可能组成的酸、碱、盐、氧化物的化学式填在相应的位置。H+酸根离子金属离子OH-金属离子酸根离子HNO3Fe(OH)3Fe(NO3)3 H2O盐碱氧化物化合物酸酸几种常见的酸酸的通性溶液 PH值盐酸硫酸一 . 酸一、常见的酸1 、酸的涵义:电离时产生的阳离子只有氢离子的化合物叫做酸 .2 、酸的结构 = H + + 盐酸 (HCl) 、 硫酸 (H2SO4) 、 硝酸(HNO3) 、碳酸 (H2CO3) 等。笔记名称结构酸根离子√3 、三种常见的酸 ① 盐酸(俗名 HCl ) [ 物理性质 ] a. 盐酸( HCl )是氯化氢的水溶液常用的浓盐酸中溶质的质量分数为 37% ~ 38% ,密度为 1·19 克 / 厘米3 。b· 纯净的盐酸是无色透明的液体,工业用盐酸因含有 FeCl3 等杂质而常呈黄色。c· 打开浓盐酸的试剂瓶,会挥发出有刺激性气味的气体,在瓶口有白雾形成,因此浓盐酸具有挥发性。 敞口放置 浓盐酸 氯化氢气体与空气 中水蒸气结合,形 成盐酸的小液滴。白雾挥发性② 硫酸( H2SO4 )a. 纯硫酸是无色、粘稠、油状的液体 纯硫酸是无色粘稠油状液体 , 难挥发,密度较大,约为 1.84g/cm3 ,可与水互溶。常用的浓硫酸质量分数是 98%.b. 浓硫酸具有脱水性 . 用玻璃棒蘸取少量浓硫酸点在纸上或火柴梗 上 , 可观察到纸上或火柴梗炭化而变黑 ,说明浓硫 酸具有脱水性 . 脱水性:是浓硫酸夺取有机物中氢、氧元素 ( 2 : 1 ),生成水。是化学性质c. 浓硫酸具有吸水性 . 浓硫酸还能直接吸收空气中的水分 , 而具有吸水性 .d. 浓硫酸具有很强的腐蚀性 , 实验时应十分小心 . 如果浓硫酸不慎溅到皮肤上 , 要先用干布擦去 , 然后用大量水冲洗 , 最后用小苏打溶液冲洗 , 严重时立即送医院 .吸水...