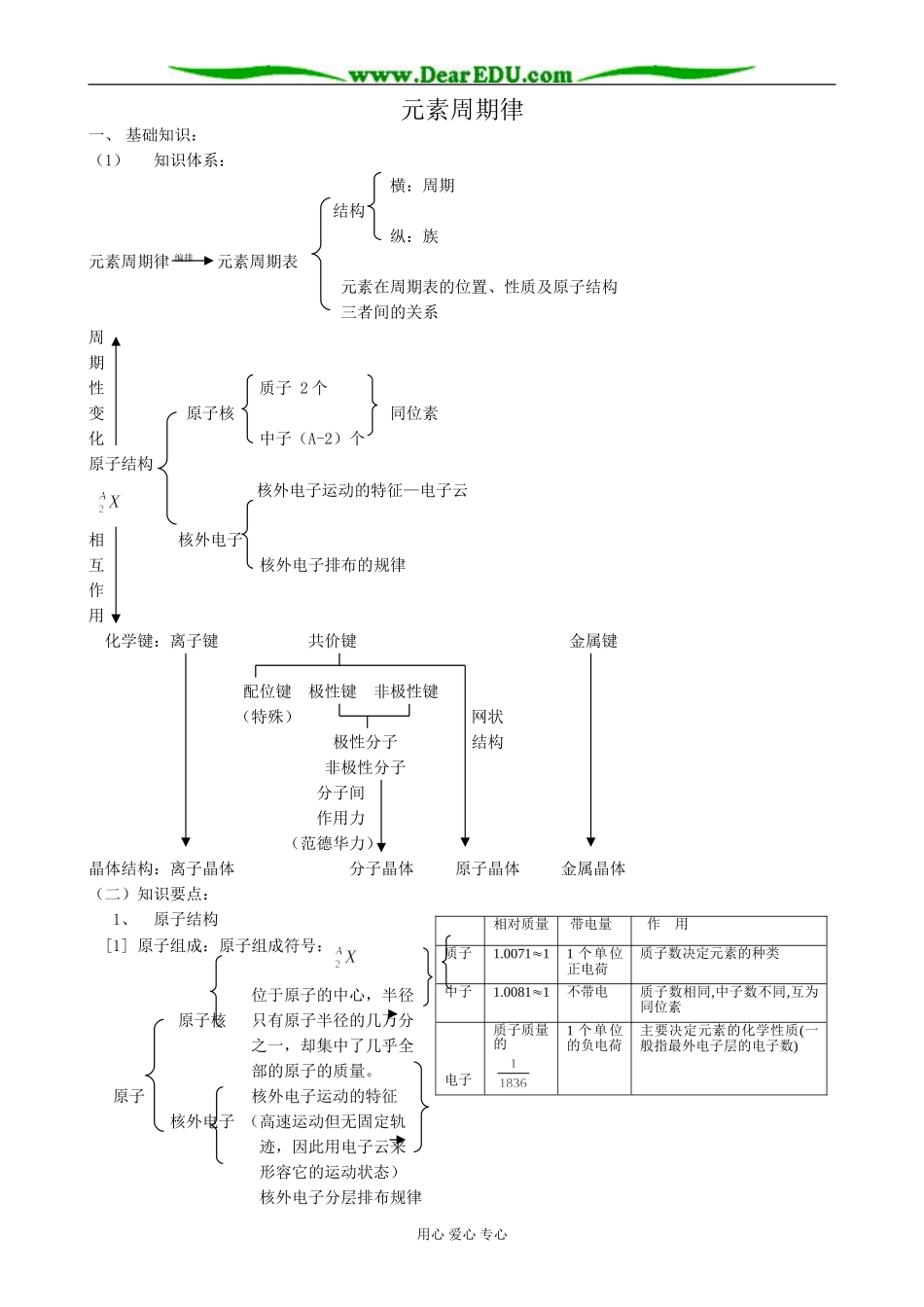
元素周期律一、基础知识:(1)知识体系:横:周期结构纵:族元素周期律编排元素周期表元素在周期表的位置、性质及原子结构三者间的关系周期性质子2个变原子核同位素化中子(A-2)个原子结构核外电子运动的特征—电子云相核外电子互核外电子排布的规律作用化学键:离子键共价键金属键配位键极性键非极性键(特殊)网状极性分子结构非极性分子分子间作用力(范德华力)晶体结构:离子晶体分子晶体原子晶体金属晶体(二)知识要点:1、原子结构[1]原子组成:原子组成符号:位于原子的中心,半径原子核只有原子半径的几万分之一,却集中了几乎全部的原子的质量。原子核外电子运动的特征核外电子(高速运动但无固定轨迹,因此用电子云来形容它的运动状态)核外电子分层排布规律用心爱心专心相对质量带电量作用质子1.007111个单位正电荷质子数决定元素的种类中子1.00811不带电质子数相同,中子数不同,互为同位素电子质子质量的1个单位的负电荷主要决定元素的化学性质(一般指最外电子层的电子数)①各电子层最多容纳的电子数目为2(n为层数)②最外电子层电子数目不超过8个③次外电子层电子数目不超过18个④遵循能量最低原理[2]n种关系:①质量数(A)=质子数(Z)+中子数(N)②质子数=核电荷数A:若质子数=核外电子数(原子)B:若质子数>核外电子数(阳离子)C:若质子数<核外电子数(阴离子)质子数-电荷数=核外电子数如:Al3+核外电子数=13-3=10S2-核外电子数=16-(-2)=18③A:原子的原子量(同位素的原子量):以一种碳原子()的质量的作为标准,某种同位素的一个原子质量跟它相比较所得的数值(相对质量)就是该种原子的原子量(同位素的原子量)。如的原子量为34.969,的原子量为36.966。B:某种元素的原子量:是根据各种天然同位素的原子量,按各种天然同位素原子所占的一定百分比(原子微粒数的百分比)算出的平均值(即为元素原子量表中数值)。如:氯元素的原子量34.969×75.77%+36.969×24.23%=35.453C:某种元素的近似原子量:根据各种天然同位素的质量数,按各种天然同位素的原子所占的一定百分比(原子微粒数的百分比)算出平均值。如:氯元素的近似原子量35×75.77%+37×24.23%=35.4852、元素周期律及元素周期表[1]元素周期律:元素的性质随着元素的原子序数的递增而呈周期性变化的规律。元素周期律从自然科学上有力地论证了事物变化的量变引起质变的规律性。[2]元素周期表:把己知的元素根据元素的原子电子层结构按原子序数递增的顺序排列成的表(横行-具有相同的电子层数的元素,纵行-最外电子层的电子数目相同的元素)[3]相互关系与知识网络:①相互关系:元素性质的周期性变化是元素原子的核外电子排布呈现周期性变化的必然结果。元素周期表则是元素周期律的具体表现形式,它表现了元素之间的相互联系的规律。②知识网络用心爱心专心需注意:A:周期序数=该周期元素原子的核外电子层数B:主族族序数=该主族元素原子的最外电子层电子数=该主族元素的最高正化合价C:原子序数=元素原子的质子数=元素原子的核电荷数D:主族元素负化合价=-(8-族序数)[4]元素周期表中同周期、同主族元素性质递变规律:项目同周期(从左右)同主族(从上下)电子层结构电子层数相同最外电子层电子数渐多电子层数递增最外电子层电子数相同原子半径大小突大(O族)小大主要化合价最高正价+1+7非金属元素负价=-(8-族序数)最高正价=族序数(O,F除外)非金属元素负价=-(8-族序数)失电子能力逐渐减小逐渐增大得电子能力逐渐增大逐渐减小金属性逐渐减弱逐渐增强非金属性逐渐增强逐渐减弱最高价氧化物对应的水化物酸碱性酸性逐渐增强碱性逐渐减弱酸性逐渐减弱酸性逐渐增强非金属气态氢化物形成难易;稳定性、还原性形成由难易稳定性逐渐增强还原性逐渐减弱形成由易难稳定性逐渐减弱还原性逐渐增强3、化学键与晶体结构[1]从整体上认识化学键与晶体结构的相互关系:用心爱心专心[2]切实掌握化学键的概念、分类、实质与特征:类型项目离子键共价键金属键非极性键极性键本质阴、阳离子间通过静电作用形成相邻原子间通过共用电子对(电子云重叠)与原子核间的静电作用形成金属阳离子与自由电子间较强作用成...