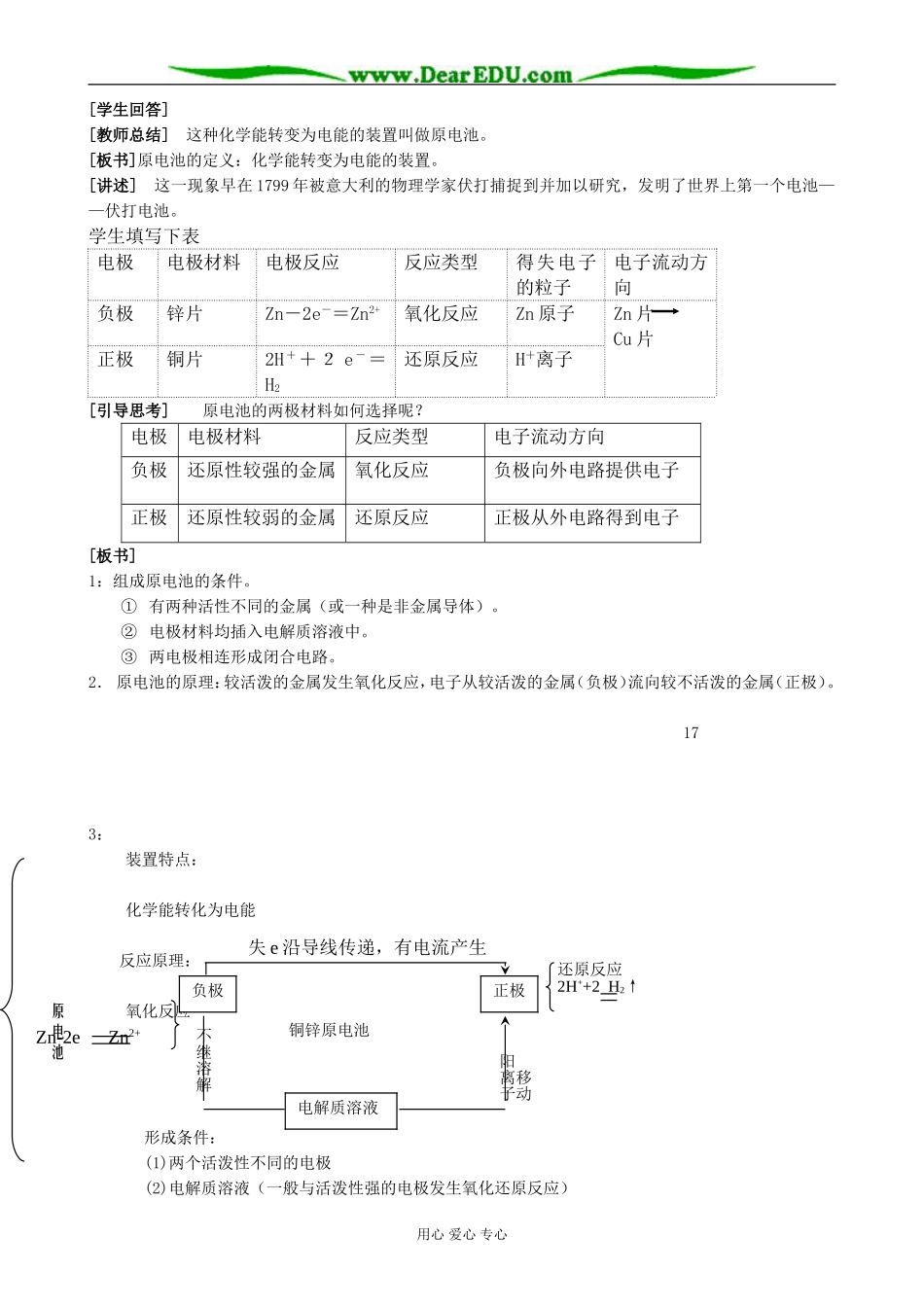
原电池原理及应用●教学目的要求1、使学生理解原电池原理。2、常识性介绍日常生活中常用的化学电源和新型化学电池。3、使学生了解金属的电化学腐蚀。●教学重点、难点:教学重点:原电池原理。教学难点:金属的电化学腐蚀。教学过程[引言]前几节我们学习了有关金属的知识,了解了铁和铜的性质。铁是比较活泼的金属,能溶于稀硫酸,铜是不活泼金属,不溶于稀硫酸。如果我们把铁和铜连接在一起,同时放到稀硫酸中,会发生什么现象呢?下面我们做这个实验。[学生实验]见教材图4-20。[提问]大家看到了什么现象?[讲述]把铁丝和铜丝的上端连接在一起,放入稀硫酸中,在金属丝中的电子流动,构成一个小电池,我们叫它原电池。下面我们就来研究原电池的原理及应用。[板书]一:原电池原理及应用[学生实验]用锌片、铜片、稀硫酸按下列要求做实验。实验步骤现象1.锌片插入稀硫酸2.铜片插入稀硫酸3.锌片和铜片上端连接在一起插入稀硫酸4.锌片和铜片之间连电流表5.用干电池判断电流的方向16[设疑]1.锌片和铜片分别插入稀硫酸有什么现象发生?2.锌片和铜片用导线连接后插入稀硫酸中,铜片上为什么有气泡产生?3.锌片的质量有无变化?溶液中c(H+)如何变化?4.写出锌片和铜片上变化的离子方程式。5.电子流动的方向如何?[学生讨论][板书]锌片Zn-2e-=Zn2+氧化反应铜片2H++2e-=H2还原反应电子由锌片经导线流向铜片[讲述]我们知道,物质发生反应时,常伴有化学能与热能、光能等的相互转化。例如,镁条在空气中燃烧的化学反应,伴有放热、发光等现象。这说明化学能转变为热能和光能。那么,我们做的这个实验是化学能转变为哪种能呢?用心爱心专心[学生回答][教师总结]这种化学能转变为电能的装置叫做原电池。[板书]原电池的定义:化学能转变为电能的装置。[讲述]这一现象早在1799年被意大利的物理学家伏打捕捉到并加以研究,发明了世界上第一个电池——伏打电池。学生填写下表电极电极材料电极反应反应类型得失电子的粒子电子流动方向负极锌片Zn-2e-=Zn2+氧化反应Zn原子Zn片Cu片正极铜片2H++2e-=H2还原反应H+离子[引导思考]原电池的两极材料如何选择呢?电极电极材料反应类型电子流动方向负极还原性较强的金属氧化反应负极向外电路提供电子正极还原性较弱的金属还原反应正极从外电路得到电子[板书]1:组成原电池的条件。①有两种活性不同的金属(或一种是非金属导体)。②电极材料均插入电解质溶液中。③两电极相连形成闭合电路。2.原电池的原理:较活泼的金属发生氧化反应,电子从较活泼的金属(负极)流向较不活泼的金属(正极)。173:装置特点:化学能转化为电能反应原理:氧化反应形成条件:(1)两个活泼性不同的电极(2)电解质溶液(一般与活泼性强的电极发生氧化还原反应)用心爱心专心原电池Zn-2eZn2+负极失e沿导线传递,有电流产生正极不继溶解电解质溶液铜锌原电池移动阳离子还原反应2H++2H2↑(3)形成闭合回路(或在溶液中接触)[例1]下列叙述中正确的是()A.构成原电池正极和负极的材料必须是两种金属。B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极。C.马口铁(镀锡铁)破损时与电解质溶液接触锡先被腐蚀。D.铜锌原电池工作时,若有13克锌被溶解,电路中就有0.4mol电子通过。[分析]两种活动性不同的金属与电解质溶液能够组成原电池,但不能因此说构成原电池电极的材料一定都是金属,例如锌和石墨电极也能跟电解质溶液组成原电池。在原电池中,活动金属中的电子流向不活动的电极,因此活动金属是负极。镀锡铁表皮破损后与电解质溶液组成原电池,铁较锡活泼,铁先失电子被腐蚀。铜锌原电池工作时,锌负极失电子,电极反应为Zn–2e==Zn2+,1molZn失去2mol电子,0.2mol锌(质量为13克)被溶解电路中有0.4mol电子通过。故选D。[例2]把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若A、B相连时,A为负极;C、D相连,D上有气泡逸出;A、C相连时A极减轻;B、D相连,B为正极。则四种金属的活泼性顺序由大到小排列为()A.A>B>C>DB.A>C>B>DC.A>C>D>BD.B>D>C>A[分析]金属组成原电池,相对活泼金属失去电子作负极,相...