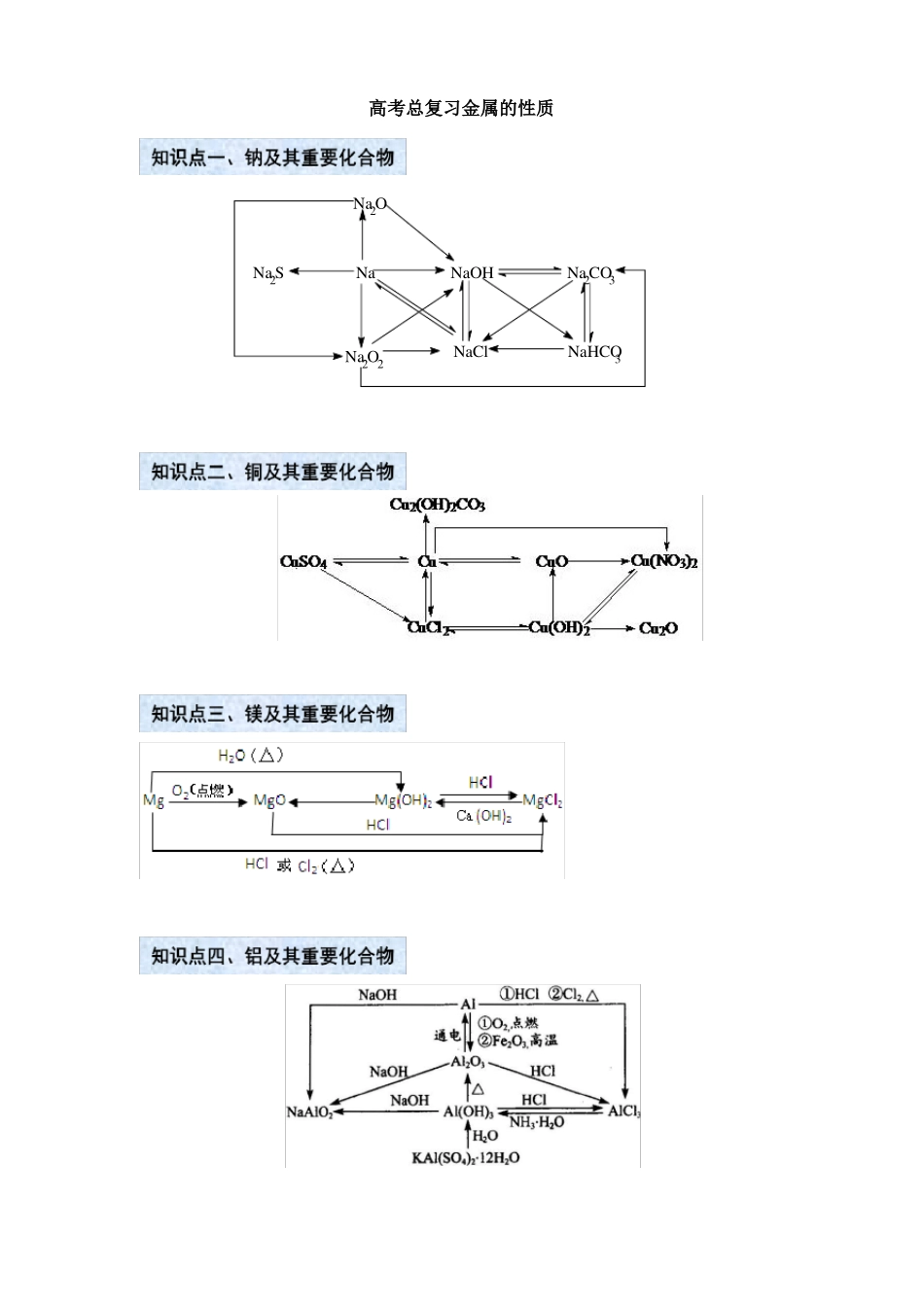
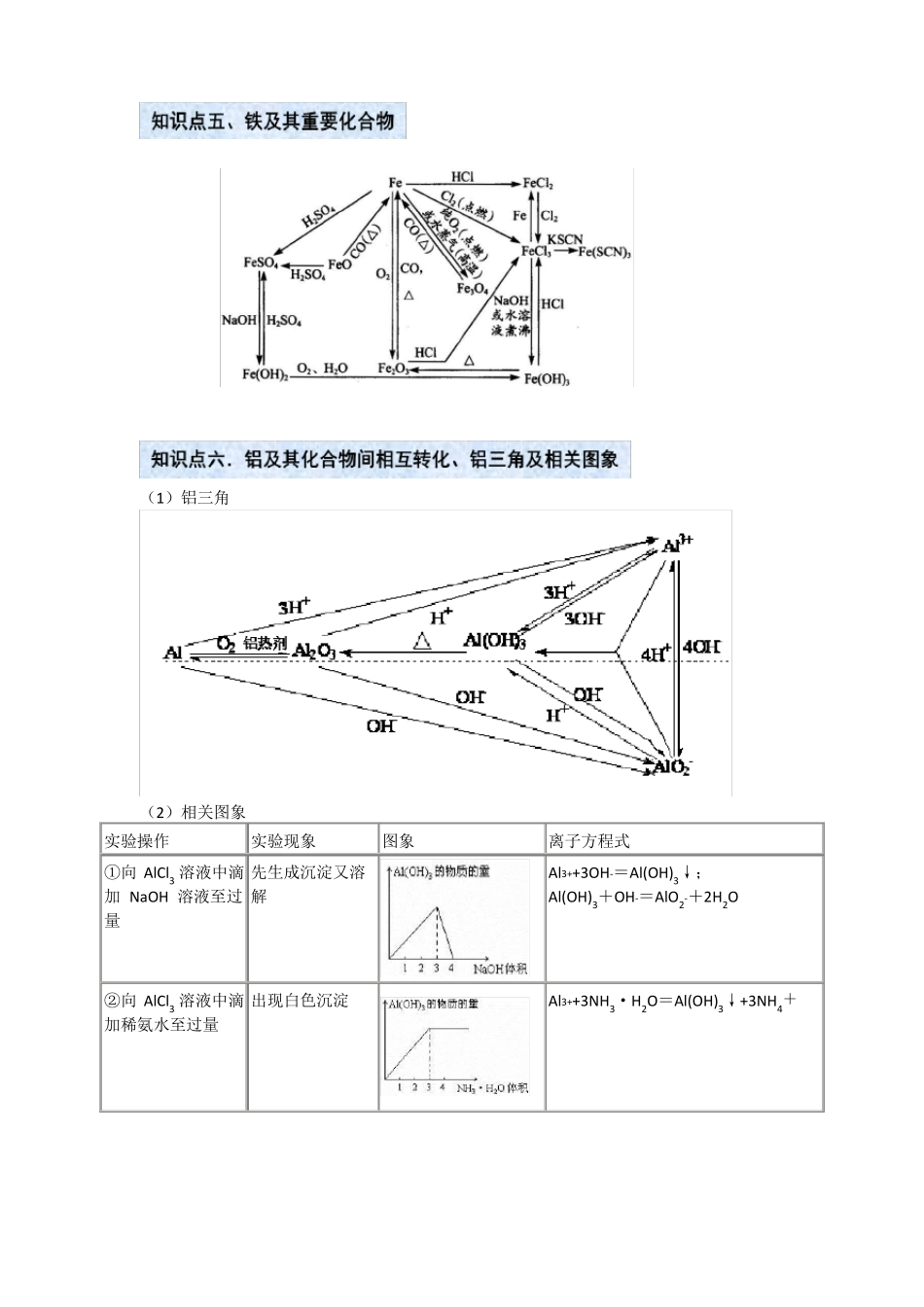
高考总复习金属的性质Na2ONa2SNaNaOHNa2CO3Na2O2NaClNaHCO3(1)铝三角(2)相关图象实验操作实验现象图象离子方程式Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O①向AlCl3溶液中滴先生成沉淀又溶加NaOH溶液至过解量②向AlCl3溶液中滴出现白色沉淀加稀氨水至过量Al3++3NH3·H2O=Al(OH)3↓+3NH4+③向NaOH溶液中开始无明显变化,滴加AlCl3溶液至过一段时间后出现量沉淀④向可溶性偏铝酸先沉淀又溶解盐溶液中滴加盐酸至过量⑤向NaAlO2溶液中先无明显变化,后逐渐通入CO2气体出现沉淀至过量Al3++4OH-=AlO2-+2H2O;3AlO2-+Al3++6H2O=4Al(OH)3↓H++AlO2-+H2O=Al(OH)3↓;Al(OH)3+3H+=Al3++3H2OAlO-2+2H2O+CO2(过量)=Al(OH)3↓+HCO-32AlO2-+3H2O+CO2(少量)=2Al(OH)3↓+CO2-3⑥向盐酸中滴加出现白色沉淀NaAlO2溶液至过量4H++AlO2-=Al3++2H2O;3AlO2-+Al3++6H2O=4Al(OH)3↓要点诠释:--⑴Al(OH3)的两性:H2O+AlO2+H+Al(OH)3Al3++3OH酸式电离碱式电离-当向Al(OH)3中加入酸溶液,由于H+消耗OH,故平衡向碱式电离方向移动,使Al(OH)3-溶解生成含Al3+的溶液。当向Al(OH)3中加入强碱溶液时,由于OH消耗H+,故平衡向酸式-电离方向移动,也使Al(OH)3溶解生成含AlO2的溶液。⑵铝热反应及应用:2Al+Fe2O32Fe+Al2O3;4Al+3MnO23Mn+2Al2O3铝热剂:铝粉和金属氧化物;助燃剂:KClO3;引燃剂:镁条。铝热反应应用:焊接钢轨,冶炼熔点较高的金属如:钒、铬、锰等。⑶既能与强酸又能与强碱反应的物质:①金属单质:Al;②两性氧化物:Al2O3;③两性氢氧化物Al(OH)3;④弱酸的酸式盐:NaHCO3、NH4HCO3等;⑤弱酸铵盐:(NH4)2CO3、(NH4)2S;⑥氨基酸、蛋白质等。1.铁⑴铁的原子结构:位于第四周期Ⅷ族,属过渡元素。原子结构示意图:;常见价态+2,+3价。⑵物理性质:①常温下,纯铁是银白色具有金属光泽的金属(纯铁的抗蚀力相当强),易导电、导热,有延展性。②铁的熔沸点都很高:熔点是1535℃,沸点是2750℃。密度7.86g/cm3。③铁能被磁体吸引,在磁场的作用下,自身也能产生磁性。⑶化学性质:铁是比较活泼的常见金属,当铁跟弱氧化剂反应时:Fe-2e=Fe2+;当跟强氧化剂反应时:Fe-3e=Fe3+。①与铁生成+3价的有:Cl2、Br2、浓硫酸、硝酸等。2Fe+3Cl2点燃2FeCl32Fe+3Br2=2FeBr3Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O(HNO3过量)Fe+2Fe(NO3)3=3Fe(NO3)23Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O(Fe过量)②与铁生成+2价的有:I2、S、稀硫酸、盐酸、Fe3+、Cu2+等。Fe+I2=FeI2Fe+SFeSFe+Cu2+=Fe2++CuFe+2H+=Fe2++H2↑Fe+2Fe3+=3Fe2+③与铁生成Fe3O4的有:O2、H2O等。3Fe+2O23Fe+4H2O(g)2.铁的氧化物铁的氧化物铁的化合价俗称状态和颜色FeO+2价——黑色固体Fe3O4+2价,+3价磁性氧化铁黑色晶体Fe2O3+3价铁红红棕色固体Fe3O4+4H2点燃Fe3O4还原性:与氧气、硝酸主要用途3.铁的氢氧化物名称化学式分类性质色态水溶性与酸反应还原性稳定性制法原理现象可被氧化——可被氧化炼铁、铝热剂一般不再被氧化炼铁、铝热剂、颜料氢氧化亚铁Fe(OH)2碱白色固体不溶于水Fe(OH)2+2H+=Fe2++2H2O氢氧化铁Fe(OH)3碱红褐色固体不溶于水Fe(OH)3+3H+=Fe3++3H2O4Fe(OH)2+O2+2H2O=4Fe(OH)32Fe(OH)3Fe2O3+3H2O(受热分解)Fe3++3OH-=Fe(OH)3↓红褐色沉淀Fe2++2OH-=Fe(OH)2↓白色絮状沉淀要点诠释:Fe(OH)2的制备①.Fe(OH)2可由硫酸亚铁溶液跟氢氧化钠溶液起反应制得。Fe(OH)2为白色絮状沉淀,易被空气中O2迅速氧化成Fe(OH)3。因此,白色絮状沉淀能迅速变成灰绿色,最终变成红褐色。Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3②.硫酸亚铁溶液要现配,配制所用蒸馏水要煮沸,以减少蒸馏水中溶解的氧,防止亚铁离子被氧化。③.要将吸有NaOH溶液的胶头滴管插到液面以下,或在液面上覆盖一层苯或煤油(不能用CCl4),以隔绝空气,防止空气与Fe(OH)2接触发生反应。4.Fe2+、Fe3+的鉴别鉴别方法观察法Fe2+浅绿色Fe3+黄色①现象:红褐色沉淀褐色)迅速灰绿色-①现象:白色沉淀②反应:Fe3++OH=Fe(OH)3↓(红加碱(NaOH)法最终红褐色沉淀②反应:Fe2++2OH=Fe(OH)2↓(白色)4Fe(OH)2+O2+2H2O=...