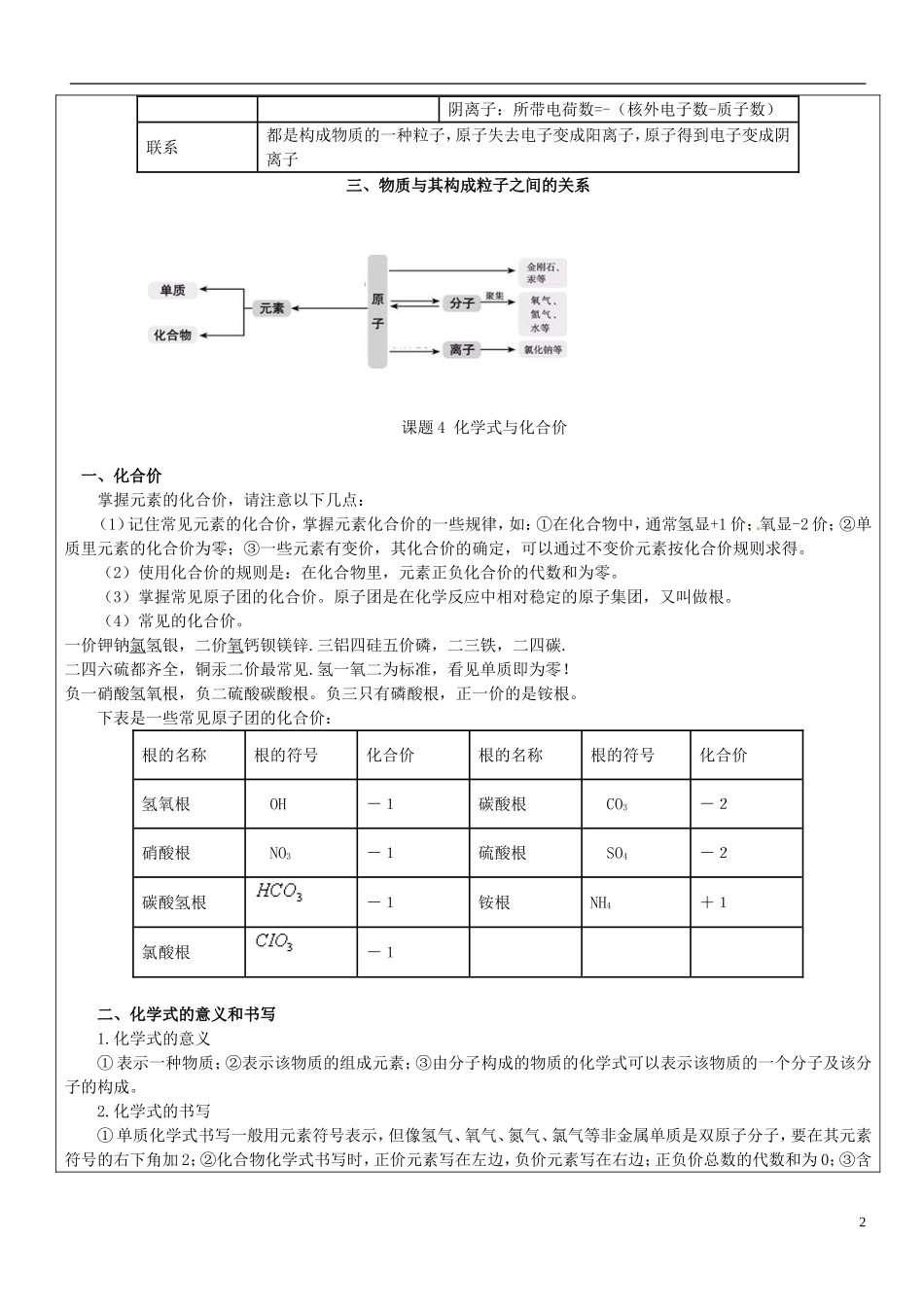
物质组成的奥秘教学内容教与学方案笔记与反思第三单元物质构成的奥秘课题3元素一、元素的概念元素是指具有相同核电荷数(即核内质子数)的一类原子的总称。学习元素概念请注意如下几点:(1)元素只讲种类,不讲个数;一般用“组成”,而分子用“构成”(2)一种元素区别于另一种元素的关键在于原子的质子数(核电荷数)不同,或者说同种元素的原子的质子数一定相同,而中子数和电子数可能不同;(3)原子和元素的比较原子元素概念化学变化中的最小粒子具有相同核电荷数的一类原子的总称特征表示具体的粒子,也表示种类。既讲种类也讲个数。表示种类,不是针对具体的某个粒子而言。只具有宏观含义(4)我们的平时所说的“补铁、补钙”指的是补元素。(5)地壳中元素按质量计,由多到少分别是氧、硅、铝、铁。生物体内含量最多的是氧。二、元素符号1.元素符号的含义:①表示一种元素;②表示该种元素的一个原子。如H既可表示氢元素,也可表示1个氢原子。③表示一种物质,如Fe、C、P2.元素符号的书写,注意第一个字母大写,第二个字母小写。三、元素周期表元素周期表是学习和研究化学的重要工具,对于元素周期表,一要认识它的结构,二要能从元素周期表获取相应元素的信息,如元素名称、元素符号、质子课题3离子二、离子1.离子是带电的原子或原子团,离子符号的意义见右图所示(数字“2”的意义)。2.原子和离子的比较原子离子定义化学反应中的最小微粒带电的原子(或原子团)电性不带电带电荷阳离子:所带电荷数=+(质子数-核外电子数)阴离子:所带电荷数=-(核外电子数-质子数)联系都是构成物质的一种粒子,原子失去电子变成阳离子,原子得到电子变成阴离子三、物质与其构成粒子之间的关系课题4化学式与化合价一、化合价掌握元素的化合价,请注意以下几点:(1)记住常见元素的化合价,掌握元素化合价的一些规律,如:①在化合物中,通常氢显+1价;氧显-2价;②单质里元素的化合价为零;③一些元素有变价,其化合价的确定,可以通过不变价元素按化合价规则求得。(2)使用化合价的规则是:在化合物里,元素正负化合价的代数和为零。(3)掌握常见原子团的化合价。原子团是在化学反应中相对稳定的原子集团,又叫做根。(4)常见的化合价。一价钾钠氯氢银,二价氧钙钡镁锌.三铝四硅五价磷,二三铁,二四碳.二四六硫都齐全,铜汞二价最常见.氢一氧二为标准,看见单质即为零!负一硝酸氢氧根,负二硫酸碳酸根。负三只有磷酸根,正一价的是铵根。下表是一些常见原子团的化合价:根的名称根的符号化合价根的名称根的符号化合价氢氧根OH-1碳酸根CO3-2硝酸根NO3-1硫酸根SO4-2碳酸氢根-1铵根NH4+1氯酸根-1二、化学式的意义和书写1.化学式的意义①表示一种物质;②表示该物质的组成元素;③由分子构成的物质的化学式可以表示该物质的一个分子及该分子的构成。2.化学式的书写①单质化学式书写一般用元素符号表示,但像氢气、氧气、氮气、氯气等非金属单质是双原子分子,要在其元素符号的右下角加2;②化合物化学式书写时,正价元素写在左边,负价元素写在右边;正负价总数的代数和为0;③含2有原子团的物质,可将原子团看成是一个原子来书写化学式,如氢氧化镁〔〕。三、关于化学式的计算利用化学式可进行下列各种计算:①相对分子质量;②物质组成元素的质量比;③物质中某元素的质量分数。公式为四、根据化合价写化学式正价在左,负价在右1、交叉法:在元素上方标上化合价,先化简再交叉,如P为+5价,氧为-2价,交叉后为P2O52、最小公倍数法,选求出几种元素化合价的最小公倍数,再根据最小公倍数求各元素的原子数。五、根据化学式求元素化合价。先将要求的化合价设为X,再根据元素正负化合价的代数和为零列出方程。求得的X的值就是化合价。如求CO2中C的化合价,X*1+(-2)*2=0求得X的值为4,则C的化合价为+4课堂练习8.下列说法错误的是()A.氧气和水都是由分子构成的B水是由氧元素和氢元素组成的C.二氧化碳是2个碳元素和1个氧元素组成的D.一个氢气分子是由2个氢原子构成的9.下列化学符号既可以表示一种物质,又表示一个原子,还表示一种元素的是()A.B.CuC.NaClD.10.下列...