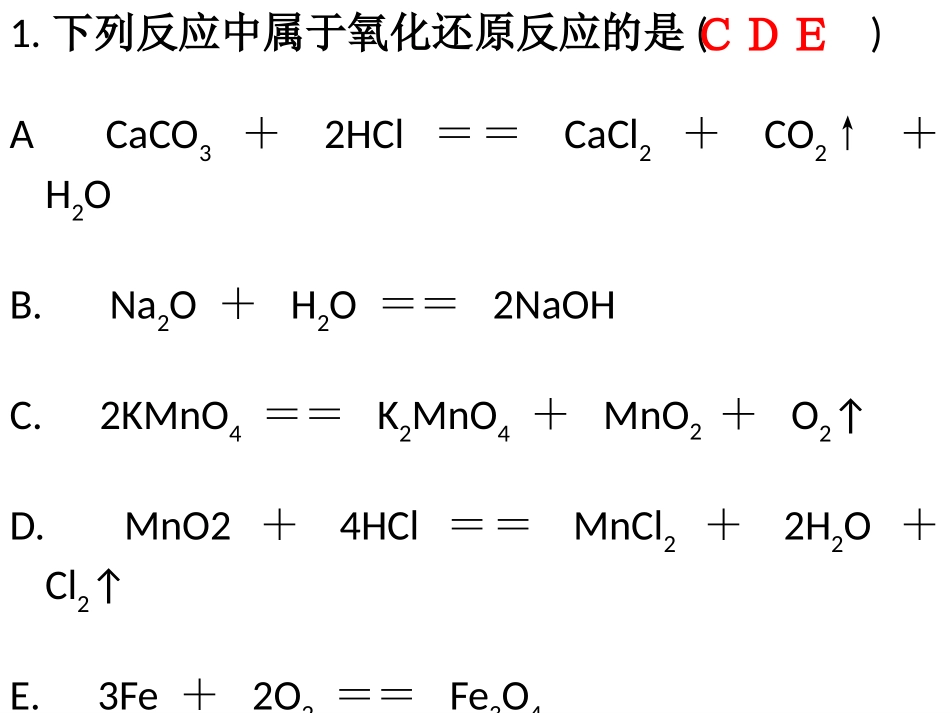
氧化还原反应第二课时旧知回顾•1、氧化还原反应的概念物质所含元素化合价的反应叫氧化反应,物质所含元素化合价的反应叫还原反应。凡是有的化学反应都是氧化还原反应。实质:有转移元素化合价升降升高降低电子1.下列反应中属于氧化还原反应的是()ACaCO3+2HCl==CaCl2+CO2↑+H2OB.Na2O+H2O==2NaOHC.2KMnO4==K2MnO4+MnO2+O2↑D.MnO2+4HCl==MnCl2+2H2O+Cl2↑E.3Fe+2O2==Fe3O4F.CuSO4·5H2O==CuSO4+5H2OCDE表示氧化还原反应的方法双线桥法:Cl2+H2O=HCl+HClO失去1e-,化合价升高,被氧化得到1e-,化合价降低,被还原表示同一元素的原子或离子得失电子的结果。双箭号跨过等号,从反应物指向生成物,起止为同一元素。注明失去或得到电子的总数,叙述要完整。注意:0+1-1失去2e-,化合价升高,被氧化2Na+Cl2=2NaCl得到2e-,化合价降低,被还原0+10-12、用双线桥法表示下列氧化还原反应•2KMnO4==K2MnO4+MnO2+O2↑•3Fe+2O2==Fe3O4•MnO2+4HCl==MnCl2+2H2O+Cl2↑讨论后完成下表:反应实例反应类型化合反应化合反应分解反应分解反应置换反应复分解反应是否氧化还原反应是是是非非非3Fe+2O2===Fe3O4点燃CaO+H2O===Ca(OH)22H2O===2H2↑+O2↑通电CaCO3===CaO+CO2↑高温Fe+CuSO4=Cu+FeSO4KOH+HNO3=KNO3+H2O非四大基本类型2H2S+SO2=3S+2H2O是氧化还原反应化合反应分解反应置换反应复分解反应氧化还原反应与四种基本类型的关系:氧化剂和还原剂在还原反应中被还原的物质是氧化剂,化合价降低,得到电子,氧化剂具有氧化性。在氧化反应中被氧化的物质是还原剂,化合价升高,失去电子,还原剂具有还原性。练习,标出氧化剂和还原剂Cl2H2OHClOHCl+=+还原剂氧化剂Fe4HNO3(稀)Fe(NO3)32H2ONO+=++还原剂氧化剂=2H2O2催化剂2H2OO2+还原剂氧化剂一定是对于反应物而言