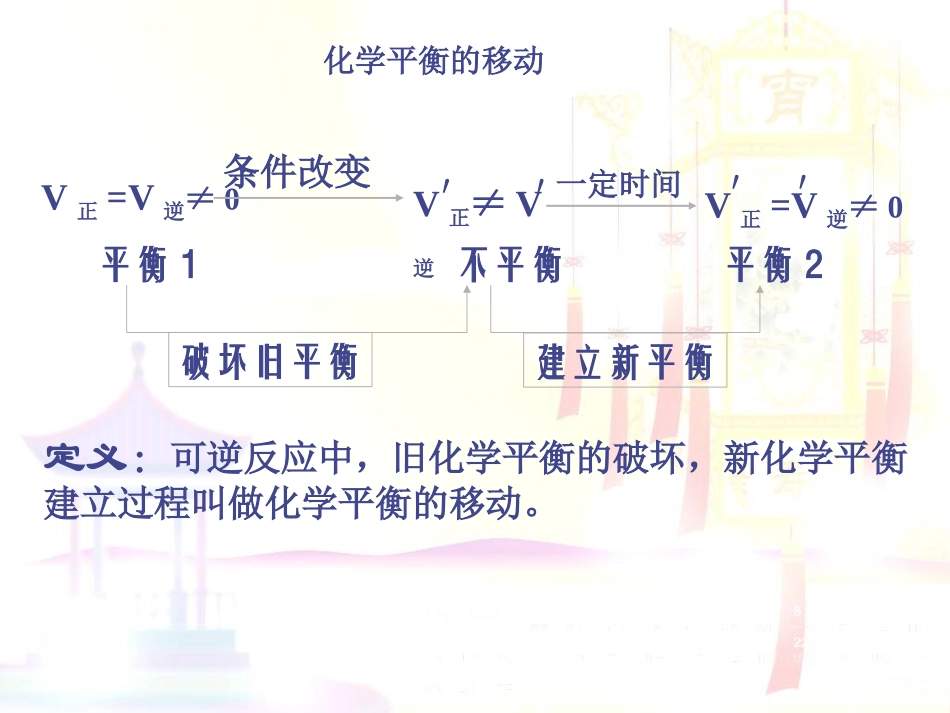
第三节化学平衡(第二课时)【复习】化学平衡状态的定义:(化学反应的限度)化学平衡的特征:一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。逆等动定变V正V逆V正=V逆vt0定义:可逆反应中,旧化学平衡的破坏,新化学平衡建立过程叫做化学平衡的移动。V正≠V逆V正=V逆≠0条件改变平衡1不平衡平衡2建立新平衡破坏旧平衡V正=V逆≠0′′一定时间化学平衡的移动′′浓度【回忆】影响化学反应速率的外界条件主要有哪些?化学反应速率温度压强催化剂【思考】如何通过改变条件来打破旧平衡?可通过改变影响反应速率的条件来打破原有平衡,建立新平衡。1、浓度对化学平衡的影响(P26)现象分析:Cr2O72-+H2O2CrO42-+2H+橙色黄色滴加3~10滴浓H2SO4滴加10~20滴6mol/LNaOHK2Cr2O7溶液增大c(H+)橙色加深C(Cr2O72-)增大平衡逆向移动平衡破坏减小c(H+)黄色加深C(CrO42-)增大平衡破坏平衡正向移动结论:增大生成物的浓度平衡向逆反应方向移动结论:减小生成物的浓度平衡向正反应方向移动溶液橙色加深溶液黄色加深现象及分析滴加饱和FeCl3溶液滴1mol/LKSCN溶液滴加NaOH溶液现象Fe3++3SCN-Fe(SCN)3增大c(Fe3+)增大c(SCN-)红色加深C[Fe(SCN)3)增大平衡破坏平衡正向移动结论:增大反应物的浓度平衡向正反应方向移动减小c(Fe3+)红色变浅C[Fe(SCN)3)减小平衡破坏平衡逆向移动结论:减小反应物的浓度平衡向逆反应方向移动Fe3++3OH-〓Fe(OH)3↓红色加深红色加深有红褐色沉淀生成,溶液红色变浅实验探究(P27实验2-6)浓度对化学平衡的影响在其他条件不变时,增大反应物浓度或减小生成物的浓度,化学平衡向正反应方向移动;减小反应物浓度或增大生成物的浓度化学平衡向逆反应方向移动学与问:其他条件不变时,如果增大反应物浓度或减小生成物浓度,正、逆反应速率如何变化?平衡如何移动?正、逆反应速率变化与平衡移动有何关系?规律:增大反应物浓度vtV正V逆V’逆V’正>V’逆V’正平衡正向移动V’正=V’逆减小生成物浓度V’正vtV逆V’逆V’正=V’逆平衡正向移动V’正>V’逆V正增大生成物浓度V’逆vtV正V逆V’正V’正=V’逆平衡逆向移动V’逆>V’正减小反应物浓度V’逆vtV逆V’正V’正=V’逆平衡逆向移动V’逆>V’正V正由以上四图可以得出结论:1)改变反应物浓度瞬间,只能改变正反应速率改变生成物浓度瞬间,只能改变逆反应速率2)改变浓度瞬间,若v(正)>v(逆),平衡向正反应方向移动若v(逆)>v(正),平衡向逆反应方向移动3)新旧平衡速率比较:增大浓度,新平衡速率大于旧平衡速率减小浓度,新平衡速率小于旧平衡速率应用:在工业生产中适当增大廉价的反应物的浓度,使化学平衡向正反应方向移动,可以提高价格较高原料的转化率,以降低生产成本2SO2(g)+O2(g)SO3(g)的平衡体系中,为了提高SO2的利用率,可采用什么措施?催化剂练习:可逆反应H2O(g)+C(s)CO(g)+H2(g)在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?CO的浓度有何变化?①增大水蒸气浓度②加入更多的碳③增加H2浓度①平衡正向移动,CO浓度增大②平衡不移动,CO浓度不变③平衡逆向移动,CO浓度减小小结:增加固体或纯液体的量不能改变其浓度,也不能改变速率,所以V(正)仍等于V(逆),平衡不移动。2、温度对化学平衡的影响P28实验探究(实验2-7)2NO2(气)N2O4(气)△H=-56.9kJ/mol(红棕色)(无色)NO2浓度增大NO2浓度减小混合物受热时颜色()混合物遇冷时颜色()现象分析:加深变浅平衡向吸热反应方向移动平衡向放热反应方向移动温度对化学平衡的影响在其它条件不变的情况下:温度升高,会使化学平衡向着吸热反应的方向移动;温度降低,会使化学平衡向着放热反应的方向移动。升温对吸热反应有利、降温对放热反应有利规律:1、混和物受热时,速率均(),但,故平衡向方向移动;2、混和物遇冷时,速率均(),但,故平衡向方向移动;增大(Ѵ吸)>(Ѵ放)吸热反应减小(Ѵ吸)<(Ѵ放)放热反应vtvtV’吸V’放V’吸=V’放V’放V’吸V’放=V’吸升高温度平衡向吸热方向移动降低温度平衡放热方向移动t1化学平衡的移动,是由于外界条件的改变而引起V正≠V逆【小结】[总结]改变反应条件时平衡移动的方向改...