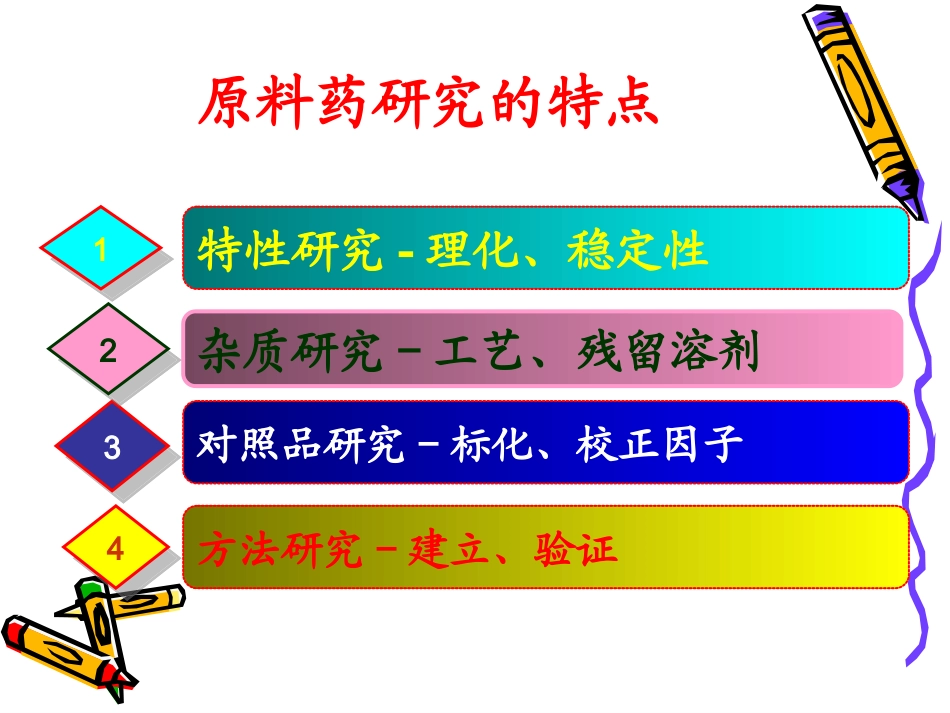
化学原料药质量研究化学原料药质量研究及原始记录常见问题讨论及原始记录常见问题讨论化学原料药质量研究化学原料药质量研究及原始记录常见问题讨论及原始记录常见问题讨论余立余立yuliyy8716@vip.sina.comyuliyy8716@vip.sina.com特性研究-理化、稳定性对照品研究-标化、校正因子方法研究-建立、验证原料药研究的特点杂质研究-工艺、残留溶剂11443322其他参考资料•《化学药物杂质研究的技术指导原则》•《化学药物质量控制分析方法验证技术指导原则》建立标准时要考虑的问题200820072006200520042003200220012000常见研究误区以及供参考的经验和体会新版药典动态对化学原料药质量研究的影响研发原始记录中常见问题及改进建议主要讨论内容Page5碘值、皂化值、酸值折光率比旋度熔点相对密度馏程吸收系数黏度凝点物理常数研究吸收系数新药尽可能详细、全面、规范注意测定方法的准确性实验样品的纯度SOP、温度校正、仪器台间差实验环境的温湿度并记录!仿制药与文献核对一致性物理常数研究吸收系数物理意义为当溶液浓度为1%(g/ml),液层厚度为1cm时的吸光度数值。研究意义及应用趋势的改变原始记录问题Page8干燥失重重金属溶液的澄清度硫酸盐酸碱度氯化物水分铵盐结晶性一般检查项研究药典变化提示•pH测定法:氢氧化钙标准缓冲液是要用25℃时取饱和溶液的上清液,所以临用时需核对温度才能取用上清液!)纯化水:取本品100ml,加饱和氯化钾溶液0.3ml。极弱电解质品种的pH值测定可采用相同的测定方法药典附录通用检测方法变化提示•重金属检查法:甲管(标准)+乙管(供试品)+丙管(标准+供试品)如丙管颜色浅于甲管则将一法改为二法进行检查勘误!第二法规定乙管(标准)中显出的颜色与甲管(供试品)比较,不得更深。药典附录通用检测方法的使用•氯化物5.0ml常用硫酸盐2.0ml检查法铵盐2.0ml铁盐1.0ml•注意标准液的取用量!•应保证灵敏检测的需要!•建议:必要时改用仪器法判断Clicktoedittitlestyle杂质控制微粒控制安全性控制注射剂所用的原辅料应从来源及工艺等生产环节进行严格控制并应符合注射用的质量要求。标准增项杂质谱的比较供注射用原料质控重点应在制剂申报资料中体现!应在制剂申报资料中体现!杂质控制力度大幅度提高未修订品种有关物质(常规)增项增指标严限度改方法TLC→HPLC等度→梯度理论板数→分离度特定杂质增订单列项盐酸阿糖胞苷项目2005年版2010年版含量限度97.0%~103.0%98.0%98.0%~~102.0%102.0%鉴别3项33+1+1项(项(+HPLC+HPLC))检查干燥失重干燥失重干燥失重----溶液的澄清度与颜色溶液的澄清度与颜色----含氯量含氯量----有关物质有关物质梯度、校正、梯度、校正、33个特定杂质个特定杂质----残留溶剂残留溶剂----炽灼残渣和重金属炽灼残渣和重金属含量测定UV吸收系数法HPLCHPLC外标法外标法*性状项下还有熔点和比旋度项,*性状项下还有熔点和比旋度项,第一次飞跃第二次飞跃纯度控制杂质控制杂质谱控制有关物质的研究-杂质质控理念的变迁杂质谱的定义•ImpurityProfile(杂质谱):Adescriptionoftheidentifiedandunidentifiedimpuritiespresentinadrugsubstance.•对存在于药品中所有已知杂质和未知杂质的总的描述。已鉴定杂质IdentifiedImpurity特定杂质SpecifiedImpurity潜在杂质PotentialImpurity杂质谱ImpurityProfile已确证了结构特征的杂质在质量标准中规定检查并有自己限度标准的杂质。已鉴定或未鉴定理论推测在生产或贮藏过程中可能产生的杂质实际产品中不一定存在存在于药品中的所有杂质组成或模式Clicktoedittitlestyle选择最优多种互补结构确证比较杂质的数与量,一致或基本一致,物质基础相同决定可否桥接已上市药品的安全有效性结果杂质谱比较杂质谱的比较项目原研厂标准拟定标准EP7.0USP34JP15含量限度按干燥品计算,每1mg的效价不得少于150单位按干燥品计算,每1mg的效价不得少于150单位按干燥品计算,每1mg效价不得少于150I.U.(非口服制剂),每1mg效价不得少于120I.U.(口服制剂按干燥品计算,每1mg中效价不得少于180USP肝素单位每1mg的效价不得少于110单位。性状白色或类白色的粉末,有引湿性白色或类白色的粉...