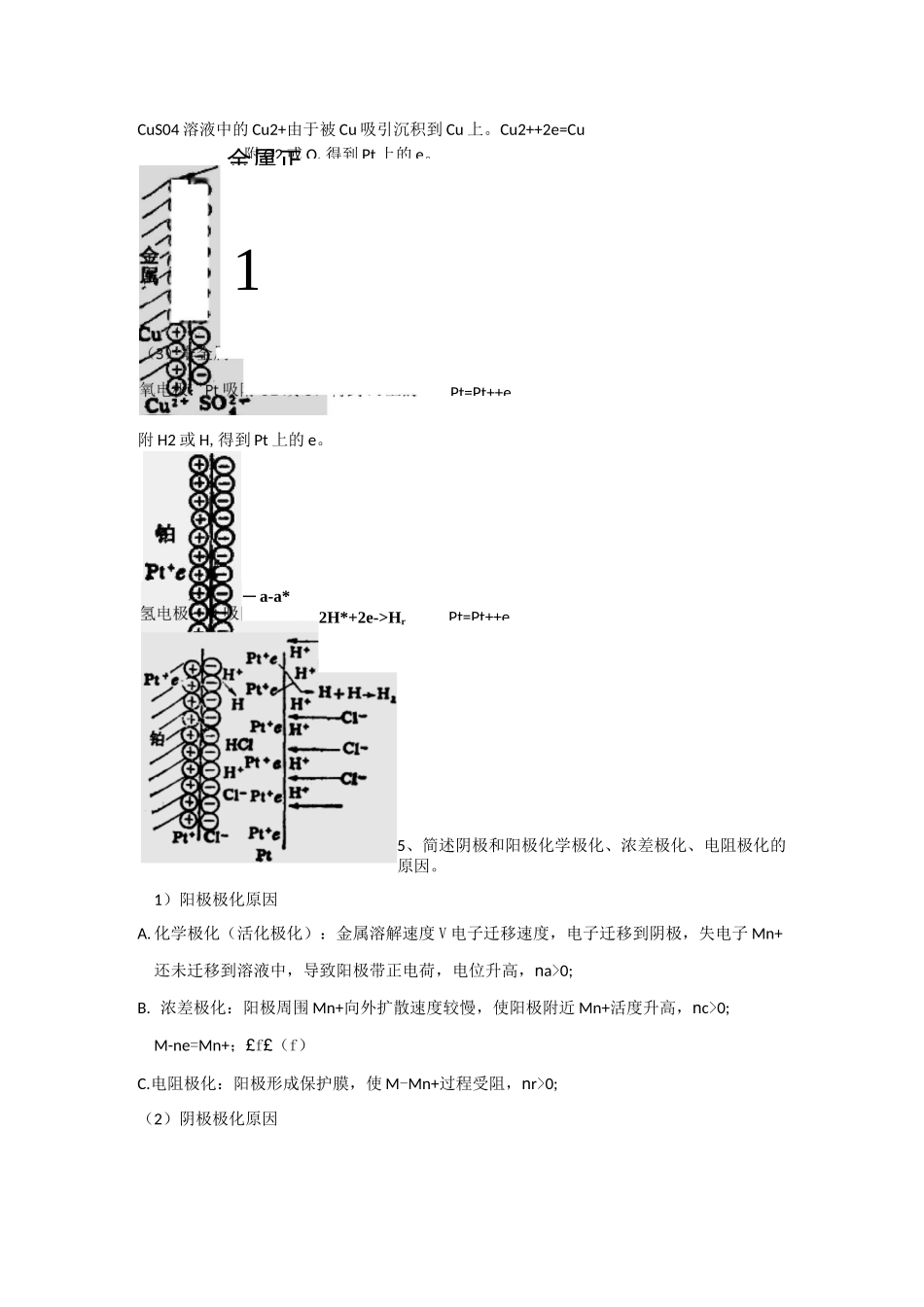
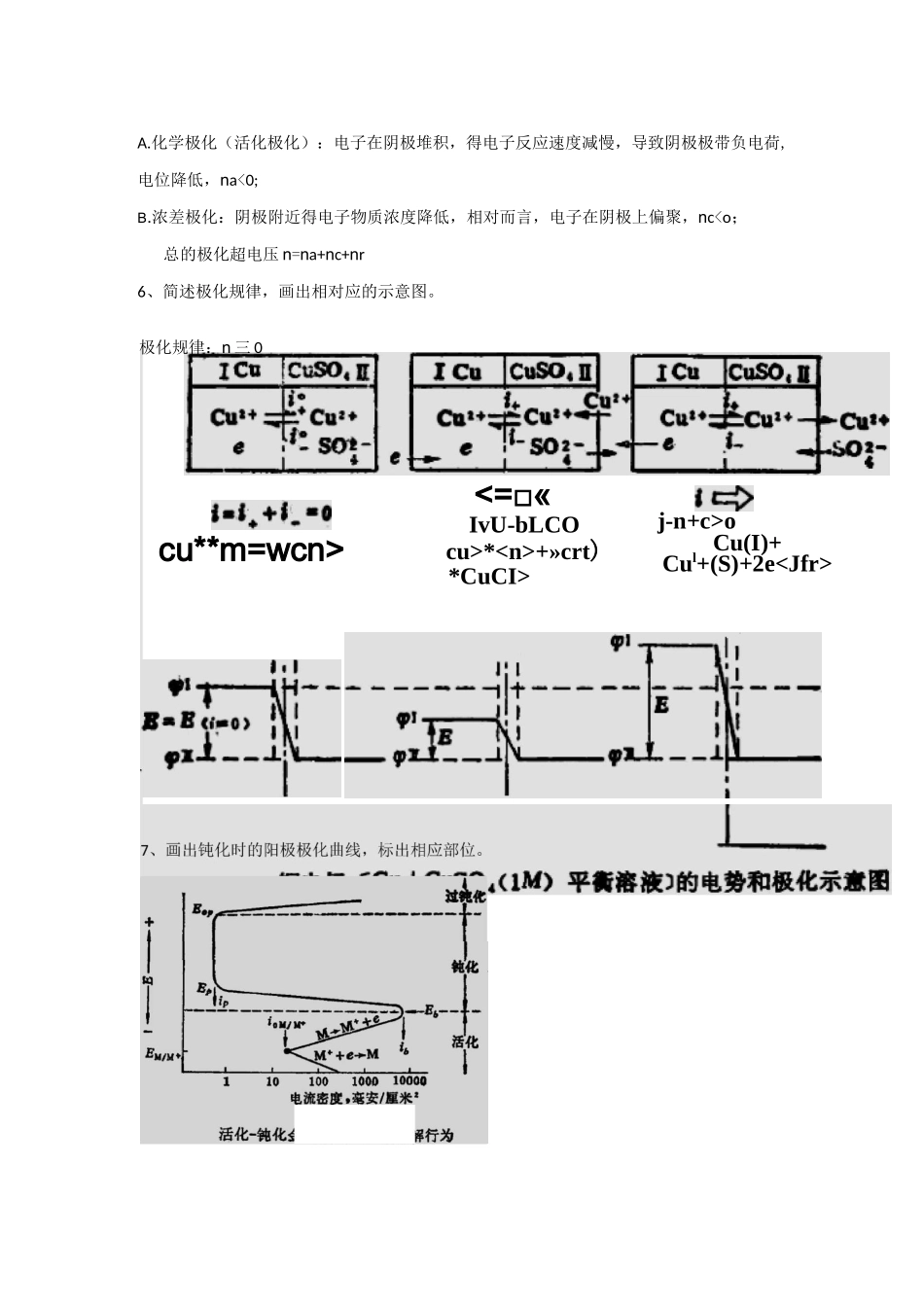
Zi?+Zn(OH):OH!1©二-◎◎©展L-0®©©毗-Qe0商®◎◎J『第一章电化学腐蚀1、何为腐蚀原电池?(外电路短路,画图)腐蚀原电池:外电路短路原电池。2、何为次生腐蚀反应?举例说明(Fe)次生腐蚀反应:阳极、阴极腐蚀产物之间发生反应。如:Fe,Cu,3%NaCI溶液中;阳极:Fe-2e=Fe2+阴极:02+2H2O+4e=40H—次生腐蚀过程:Fe2++2OH-=Fe(0H)2Fe(0H)2沉积阳、极阴交界处形成致密膜起保护作用,若Fe(0H)2进一步反应:Fe(0H)2+02+2H2O=4Fe(OH)3,脱水成铁锈xFeO.yFe2O3.2H2O疏松不起保护作用。3、微电池的种类有哪些?定义:人眼不可辨,指阳极区和阴极区尺寸小,很难区分。(1)成分不均匀钢或铸铁中的Fe、Fe3C或石墨,Fe为阳极,Fe3C或石墨为阴极;(2)组织不均匀晶界与晶粒内部,一般晶界为阳极,晶粒内部为阴极;(3)物理状态不均匀应力大晶格畸变为阳极,应力小为阴极。4、双电层有哪几种?(1)金属+H2OMn+.ne+mH2O=Mn+.mH2O+ne2)金属+金属盐溶液Ze水平电IB属+电解质溶液Pt=Pt++eCuS04溶液中的Cu2+由于被Cu吸引沉积到Cu上。Cu2++2e=Cu附H2或H,得到Pt上的e。一a-a*2H*+2e->Hr5、简述阴极和阳极化学极化、浓差极化、电阻极化的原因。1)阳极极化原因A.化学极化(活化极化):金属溶解速度V电子迁移速度,电子迁移到阴极,失电子Mn+还未迁移到溶液中,导致阳极带正电荷,电位升高,na>0;B.浓差极化:阳极周围Mn+向外扩散速度较慢,使阳极附近Mn+活度升高,nc>0;M-ne=Mn+;£f£(f)C.电阻极化:阳极形成保护膜,使M-Mn+过程受阻,nr>0;(2)阴极极化原因金属正附O2或O,得到Pt上的e。Pt=Pt++e1A.化学极化(活化极化):电子在阴极堆积,得电子反应速度减慢,导致阴极极带负电荷,电位降低,na<0;B.浓差极化:阴极附近得电子物质浓度降低,相对而言,电子在阴极上偏聚,nc极化规律:n三0<=□«IvU-bLCOcu>*+»crt)*CuCI>j-n+c>oCu(I)+Cul+(S)+2elog(i/ib致钝电流(活化峰电流)、Eb致钝电位;ip维钝电流、维钝电位范围Ep〜Eop;i0交换电流密度。8、浓差极化的表达式是什么?讨论浓差极化的影响因素••nFDC0059iid表征浓差控制时的极限电流i=i=n=00艺iogd-二)d总xcnid9、画出氢活化极化曲线,写出超电压表达式。析氢,na=土B+卡°、j二増大流逮一-1提高温度Miirfz增加浓度环境变量对浓差极化曲线的影响氨电极的活化极化曲线10、分别画出析氢反应、吸氧反应极化曲线,并讨论其控制因子。析氢腐蚀:2H++2e一H2控制因子:电化学极化(活化极化)送到的去极化过程的扩散线迁移移过程浓差控制.«2aovl>20.0oo吸氧腐蚀:O2+4e+2H2O—4OH-t"NcococoEo—E——c&IE—EoccoI=Eo—Eoca—Pa+Pc+R阴极发生去极化反应,即V反;电化学极化(活化极化)。V输>>V反时(OPG段活化控制)V输VVV反时(BFSN段扩散控制)V输~V反时(OPFSN段混合控制)达到析氢电位时(SQG段析氢吸氧共同控制)11、简述金属钝化理论。(1)成相膜理论表面上生成保护性固体产物膜,将金属和溶液机械隔开。由于氧化物膜溶解速度很小,使腐蚀速度降低。(2)吸附理论金属表面(或部分表面)上形成了氧或含氧粒子的吸附层,使金属表面的键化饱和,使阳极反应活化能增大,金属溶解速度降低。12、简述过钝化的原因。定义:在强氧化性介质中或电位很高条件下,金属表面的不溶性膜,转变为易溶解的膜,由钝化变为活化。(1)低电位区,活化反应:Fe-2e=Fe2+,E=-0.44V;Cr-2e=Cr2+,E=-0.74V(2)电位升高,阳极表面形成不溶性的Fe3O4、丫一Fe2O3、Cr2O3进入钝化状态。(3)若电位再连续升高1v以上,发生过钝化反应,钝化膜溶解。Fe3O4+8H+—3Fe3++4H2O+eCr2O3+4H2O—Cr2O72-+8H++6e13、画出典型的伊文思腐蚀极化图,并对其分析。Eo-EE-EE-Eo.rE0—E0=(cc+ca+aa)XIcaIIIcor%^Pc/|/1/:f1%£L—T1腐蚀速度:ZnMPc是阴极极化曲线的斜率,叫阴极极化率,表示阴极反应的阻力。Pa是阳极极化曲线的斜率,叫阳极极化率,表示阳极反应的阻力。R是电路的欧姆电阻R,为电阻极化率。Evans极化图的本质特征:用极化曲线的斜率来表示腐蚀电池工作的阻力,电极反应的阻力越大,极化曲...