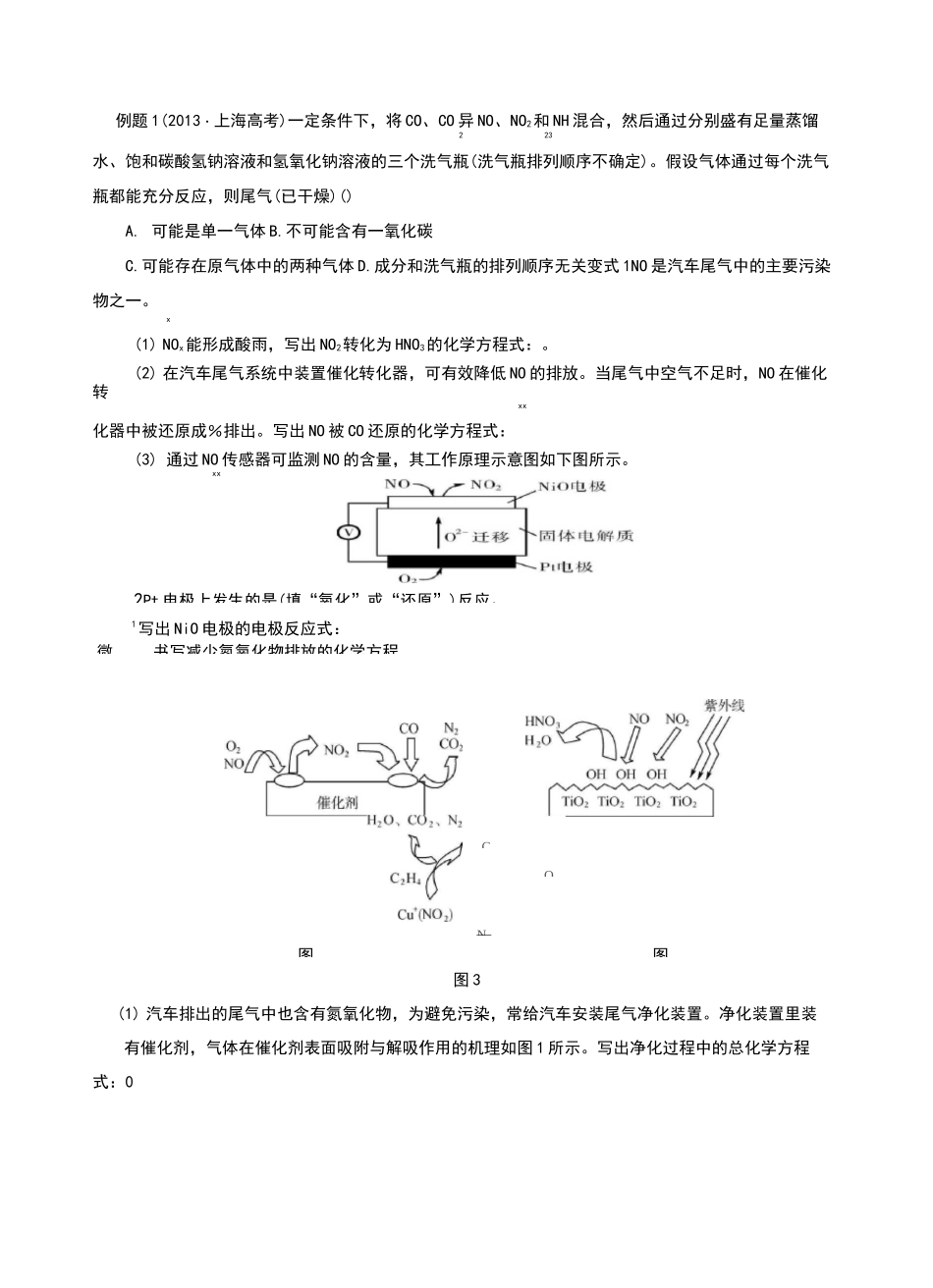
氮及其化合物考点1氮气及氮的氧化物1.氮元素的存在在自然界中,氮元素既有态,也有态,大部分氮元素以态的形式存在于空气中。2.氮气的物理性质颜色:,状态:,气味:,水溶性:溶于水。3.氮气的化学性质常温下,氮气的化学性质稳定,通常情况下不易发生化学反应。写出下列反应的化学方程式。(1)工业上合成NH:。(2)%和02在放电条件下生成NO:。⑶Mg在N2中燃烧:。4.氮的固定(1)含义:将的氮转变为的氮。(2)方式:、生物固氮、工业固氮。5.氮的氧化物氮有多种价态的氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5等。完成N°和N:的比较:NONO2物理性质颜色毒性溶解性化学性质与O2反应2NO+O—2NO22与H2O反应23NO+HO—2HNO+NO223实验室制法(用化学方程式表示)3Cu+8HNO(稀)一3Cu(NO33)+2NOT+4HO22Cu+4HNO(浓)=3Cu(NO)+2NOT+2HO3222注意:(1)氮的氧化物都是大气污染物。空气中NO2是造成光化学烟雾的主要因素(2)NO2既有氧化性又有还原性,以氧化性为主。NO2能使湿润的淀粉-KI试纸变蓝22微书写减少氮氧化物排放的化学方程ON图例题1(2013・上海高考)一定条件下,将CO、CO异NO、NO2和NH混合,然后通过分别盛有足量蒸馏223水、饱和碳酸氢钠溶液和氢氧化钠溶液的三个洗气瓶(洗气瓶排列顺序不确定)。假设气体通过每个洗气瓶都能充分反应,则尾气(已干燥)()A.可能是单一气体B.不可能含有一氧化碳C.可能存在原气体中的两种气体D.成分和洗气瓶的排列顺序无关变式1NO是汽车尾气中的主要污染物之一。x(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:。(2)在汽车尾气系统中装置催化转化器,可有效降低NO的排放。当尾气中空气不足时,NO在催化转xx化器中被还原成%排出。写出NO被CO还原的化学方程式:(3)通过NO传感器可监测NO的含量,其工作原理示意图如下图所示。xx1写出NiO电极的电极反应式:图3(1)汽车排出的尾气中也含有氮氧化物,为避免污染,常给汽车安装尾气净化装置。净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如图1所示。写出净化过程中的总化学方程式:02Pt电极上发生的是(填“氧化”或“还原”)反应。C图(1)氨气的物理性质:颜色:;气味:;密度:比空气;溶解性:溶于水(常温常压下,1体积水中大约可溶.体积氨气);熔、沸点低,易液▼32计算氨水浓度时通常③与O反应:4NH+5O232(3)NH的用途3(1)铵盐的物理性质:色晶体,.溶于NH++0H-,氨气能试纸.色(可用于检验铵(2)TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,OH能将NO、NO?氧化,如图2所示,0H与NO?反应的化学方程式为N°2+°H—吧。写出°H与NO反应的化学方程式:(3)用乙烯作为还原剂将氮的氧化物还原为N是燃煤烟气的一种脱硝(除NO)技术。其脱硝机理如图2x3,___________________________________________________________________写出该脱硝过程中乙烯和NO2反应的化学方程式:。考点2氨气及铵盐1.氨气(2)氨气的化学性质①与水反应:NH+HO—NH•HO3232.视作溶质,氨水的浓度越大,密度.弱碱性:NH・HO—32络合性:Ag++2NH•HO——一②与酸反应:实质是NH3+H+Pt。NH3是一种重要的化工原料,可用来制硝态氮肥、铵态氮肥、尿素等。2.铵盐(2)铵盐的化学性质①热不稳定性NHfl—NHHCO—43②与碱溶液的反应H+(3)N4的检验未知液=呈碱性一2湿润的色石蕊试纸变色,则证明含“H4。例题2下列说法正确的是()A.氨气与氯气相遇可能冒白烟B.氨气通入浓硫酸或浓硝酸中会被氧化C.氨气可以由所有铵盐受热分解得到D.氨气比PH3易液化是因为N—H键的键能比P—H键的键能大变式2探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是()A.将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水B.将pH=11的氨水稀释1000倍,测得pH>8,说明NH3・H20为弱碱C.加热NH』C03固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定D•将红热的铂丝伸入右图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO?核心突破1.NH3的实验室制法(1)方法一:加热固态铵盐和碱的混合物。一般加热NHCI和Ca(OH)的混合物。42A原理:2NHCI+Ca(0H)CaCI+2NHT+2H042232A装置:固体+固体■气体(与用KCIO或KMnO...