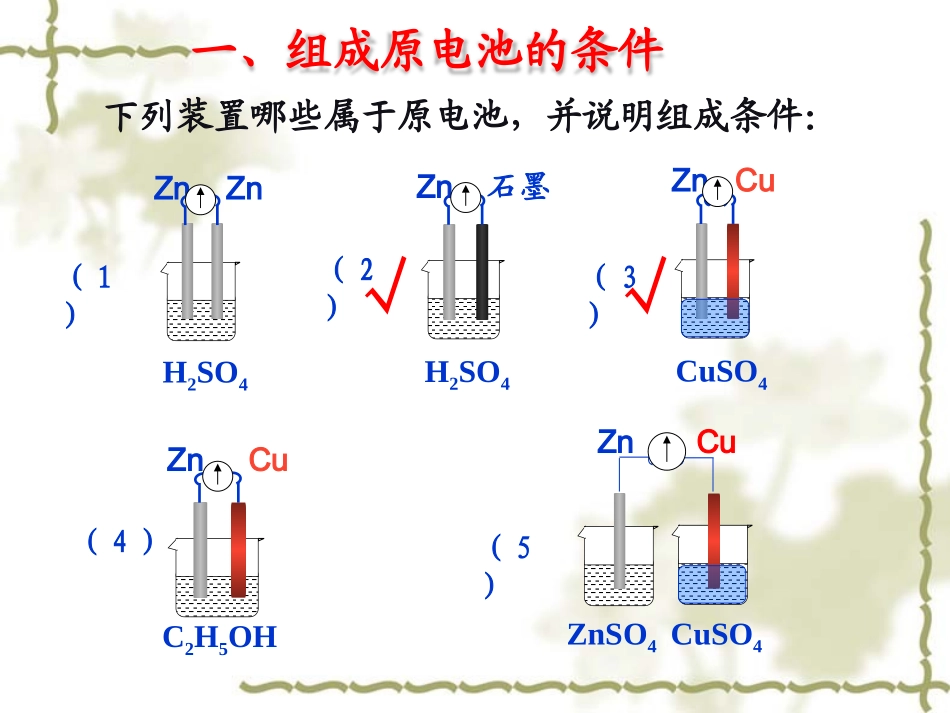
第四章电化学基础第一节原电池下列装置哪些属于原电池,并说明组成条件:H2SO4ZnZn(1)H2SO4Zn石墨(2)CuSO4ZnCu(3)C2H5OHZnCu(4)ZnCuZnSO4CuSO4(5)√√一、组成原电池的条件二、原电池的工作原理H2SO4溶液ZnCu三、原电池电极反应的书写FeCl3溶液CCu总反应:2Fe3++Cu=2Fe2++Cu2+负极反应:Cu-2e-=Cu2+正极反应:Fe3++e-=Fe2+四、原电池正负极的判断方法判断依据负极正极电极材料电子流向电流流向离子移动方向电极反应类型较活泼较不活泼阴离子移向负极阳离子移向正极发生氧化反应发生还原反应溶解、质量减小产生气体或质量增重电极上的现象(2016上海高考)图1是铜锌原电池示意图.图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示()A、铜棒的质量B、c(Zn2+)C、c(H+)D、c(SO42−)高考直通车盐桥:通常装有含琼胶的KCl饱和溶液。五、双液原电池盐桥的作用:1、连接内电路,形成闭合回路。2、平衡电荷。双液原电池的优点:避免了电极与电解质溶液直接反应,可以更彻底地将化学能转化为电能。1.(08广东高考)用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是()①在外电路中,电流由铜电极流向银电极②正极反应为:Ag++e-=Ag③实验过程中取出盐桥,原电池仍继续工作④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同A①②B.②③C.②④D.③④C高考直通车2.(07海南高考)依据氧化还原反应:2Ag++Cu==Cu2++2Ag设计的原电池如图所示,请回答下列问题:(1)电极X的材是;电解质溶液Y是;(2)银电极为电池的极,发生的电极反应为;X电极上发生的电极反应为;(3)外电路中的电子是从电极流向电极。CuAgNO3正XAgAg++e-=AgCu-2e-=Cu2+原电池组成条件工作原理正负极的判断电极反应的书写双液原电池课堂小结