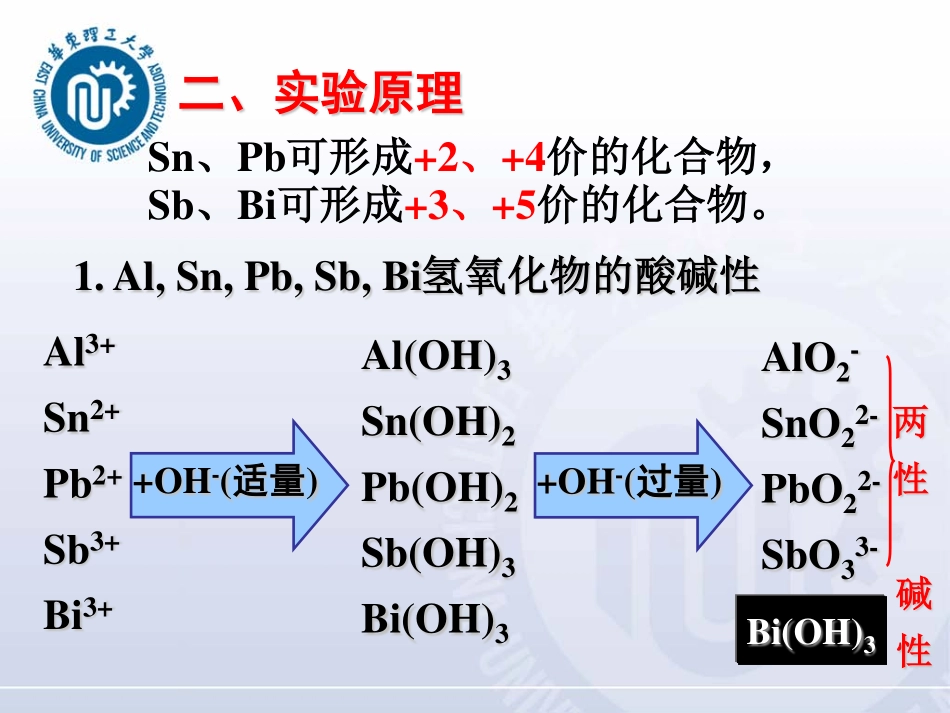
金属化合物性质(一)一、实验目的掌握主族重要金属(Al铝、Sn锡、Pb铅、Sb锑、Bi铋)化合物的有关性质:(1)氢氧化物的酸碱性(2)硫化物、硫代酸及其盐的性质。(3)化合物的氧化还原性。二、实验原理1.Al,Sn,Pb,Sb,Bi氢氧化物的酸碱性两性碱性Al3+Sn2+Pb2+Sb3+Bi3++OH-(适量)Al(OH)3Sn(OH)2Pb(OH)2Sb(OH)3Bi(OH)3+OH-(过量)AlO2-SnO22-PbO22-SbO33-Bi(OH)3Sn、Pb可形成+2、+4价的化合物,Sb、Bi可形成+3、+5价的化合物。SnS:棕色,碱性SnS2:黄色,两性偏酸性PbS:黑色,碱性Sb2S5:橙色,两性偏酸性Bi2S3:黑色,碱性Sb2S3:橙色,两性2.Al,Sn,Pb,Sb,Bi硫化物二、实验原理SnS2Sb2S3Sb2S5PbSBi2S3SnSNa2SorNa2SnS3Na3SbS3Na3SbS4PbSBi2S3SnS溶解不溶H+SnS2Sb2S3Sb2S5NaOH据此可分离硫化物3.Al,Sn,Pb,Sb,Bi化合物的氧化还原性Sn(II)有较强的还原性,易被空气中的氧氧化。2Bi3++3Na2[Sn(OH)4]+6OH-=2Bi↓+3Na2[Sn(OH)6]OH-介质:黑色此反应可鉴定Bi3+SnCl2+NaOH(过量)二、实验原理SnCl2+2HgCl2SnCl4+Hg2Cl2↓(白色)SnCl2+Hg2Cl2SnCl4+2Hg↓(黑色)H+介质:HgCl2SnCl2Hg2Cl2SnCl2Hg白色黑色此反应可鉴定Sn,Hg最终观察到的沉淀颜色可能是白黑混合而成的灰色二、实验原理三、实验步骤1.Al3+,Sn2+,Pb2+,Sb3+混合离子的分离和鉴定(P1011)保证Sn4+,Pb2+,Sb3+沉淀完全无Bi3+7-8minH2O20-30d水浴加热5min5%硫代乙酰胺*12-15d(过量)赶H2O2,搅拌,NH3·H2O(6mol⋅L-1)3%H2O2,5-6d,搅拌Al3+,Sn2+,Pb2+,Sb3+pH≈32mol⋅L-1HClV总的1/6[H+]≈0.3mol⋅L-1离心分离沉淀Al3+,Sn4+,Pb2+,Sb3+溶液三、实验步骤检验沉淀是否完全溶液若沉淀不完全,从*处重复若沉淀完全,鉴定Al3+(铝试剂,pH=9)加Mg条离心分离鉴定Pb2+K2CrO4HNO3离心分离取清液6mol⋅L-1NaOH10d沉淀(SnS2,PbS,Sb2S3)2mol⋅L-1HClpH≈3离心分离Sb2S33-,SnS32-Sb2S3,SnS2SbCl63-,SnCl62-鉴定Sb3+PbSPb2+锡片取清液鉴定Sn2+,HgCl2NaOHpH=4~5浓HCl2.氢氧化物的酸碱性(氢氧化物制两份)实验项目Al3+Sn2+Pb2+Sb3+Bi3+Mn++NaOH(现象)氢氧化物+NaOH(现象)+酸(现象)结论注意试验Pb(OH)2碱性时加HNO3或HAc,不可用HCl、H2SO4。注意:试验Pb(OH)2碱性时加HNO3或HAc,不可用HCl、H2SO4。两性氢氧化物制备时加入NaOH必须要适量。实验报告要求:画出分离鉴定过程流程图(参考P101)写出鉴定结果,描述鉴定所得实验现象并写出鉴定反应方程式(无需配平,但要完整写出反应物和产物)