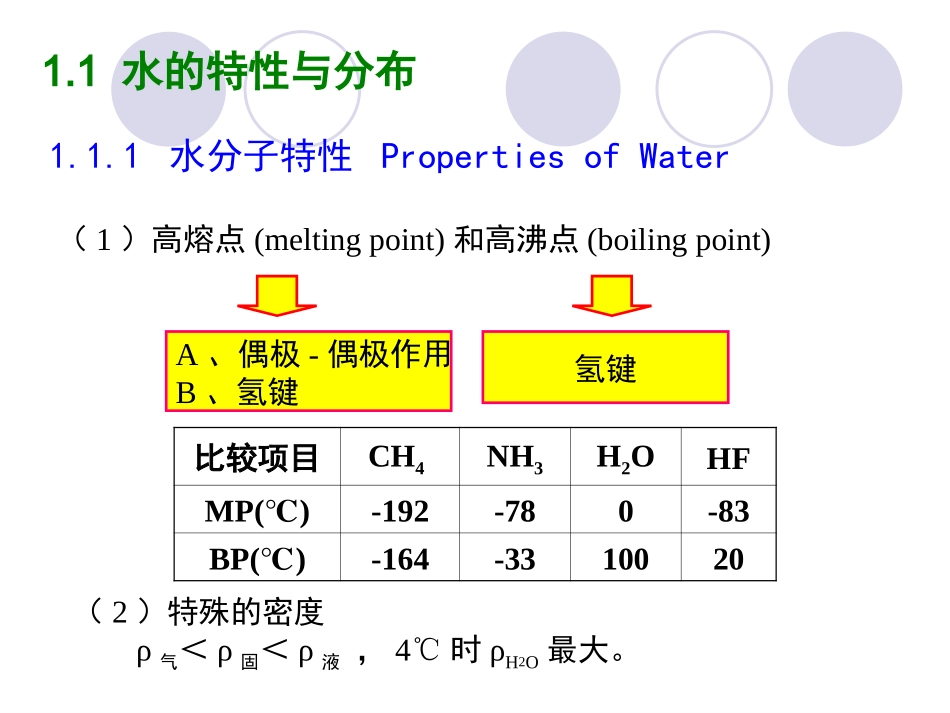
第三章水环境化学第三章水环境化学第一节水的基本特征及污染物存在形态1.1水的特性与分布1.2水的使用与循环1.3天然水的组成与基本性质1.4水中污染物及其存在形态1.1水的特性与分布(1)高熔点(meltingpoint)和高沸点(boilingpoint)比较项目CH4NH3H2OHFMP()℃-192-780-83BP()℃-164-3310020氢键A、偶极-偶极作用B、氢键(2)特殊的密度ρ气<ρ固<ρ液,4℃时ρH2O最大。1.1.1水分子特性PropertiesofWaterSummary:ImportantpropertiesofwaterPropertyEffectsandsignificanceExcellentsolventTransportnutrientsandwasteproducts,makingbiologicalprocessespossibleinanaqueousmediumMaximumdensityat4oCIcefloatsHigherheatofvaporizationthananyothermaterialDeterminestransferofheatandwaterbetweentheatmosphereandbodiesofwaterHigherheatoffusionthananyotherliquidexceptammoniumTemperaturestabilizedatthefreezingpointofwaterHigherheatcapacitythananyotherliquidexceptammoniaStabilizationoftemperaturesoforganismsandgeographicalregionsTransparenttovisibleandlonger-wavelengthfractionofUVlightAllowlightrequiredforphotosynthesistoreachconsiderabledepthinbodiesofwater1.1.2DistributionofWaterontheEarthOnlyasmallpercentage(<3%)ofwateronEarthisfreshwater.Lakesandriversaccountforjust0ver0.1%oftheearth’stotalwater1.2.1Globalwateruse(1900-2000)1.2.2HydrologiccycleEvaporationTranspirationCondensationPrecipitationProcessesthatcyclewaterbetweenairandearthsurface1.3天然水的组成与基本性质1.3.1化学成分(1)常量元素(>1mmol/L)(2)营养元素(N、P、Si、Fe、Mn、Cu)(3)微量元素(<1μmol/L)(4)溶存气体:来源于大气、火山爆发、海洋生物和化学反应,有CO2、CH4、H2S、O2(0~8.5mg/L)、N2和Ar。(5)有机质(substance):来源于陆地输入、海洋生物分泌和尸体破裂。(6)主要离子(八大离子):K+、Na+、Ca2+、Mg2+、Cl-、SO42-、HCO3-、NO3-,占天然水总离子的95-99%。水中的主要离子组成图(P101)总含盐量:TDS=[Ca2++Mg2++K++Na+]+[Cl-+SO42-+HCO3-+NO3-]1.3.2淡水与海水的对比CompositionofnaturalwatersFreshwater:dissolvedsolids<0.1%.Drinkingwaterstandard:dissolvedsolids<0.05%Majorconstituents:Ca2+,Mg2+,HCO3-.Seawater:dissolvedsolids~3.5%(Deadsea:25%)MajorconstituentsCl-19,000ppmNa+10,600ppmSO42-2,600ppmMg2+1,300ppmHCO3-140ppmCa2+400ppmBr-65ppmK+380ppm优势离子有机质海水Na+>Mg2+>Ca2+;Cl->SO42->HCO3-海水<2mg/L淡水Ca2+>Mg2+>Na+;HCO3->SO42->Cl-淡水>2mg/L(1)气体在水中的溶解性亨利定律:X(g)X(aq)气体在大气和水之间的分配达到平衡时,符合:[G(aq)]=KH×pG表3-1,3-2列出了一些气体的亨利定律常数,水的分压。1.3.3水中主要的容存气体—氧气和二氧化碳一种气体在液体中的溶解度正比于液体所接触的该种气体的分压。注意K的大小及其溶解性表3-2水在不同温度下的分压T(℃)P(H2O)(×105Pa)T(℃)P(H2O)(×105Pa)05101520250.006110.008720.012280.017050.023370.0316730354045501000.042410.056210.073740.095810.123301.01300利用亨利定律时的注意事项在计算气体的溶解度时,需考虑水蒸气对气体分压的影响Px=(Pa-PH2O)×fxPa:大气压;fX:大气中气体的摩尔分数亨利定律不能反应气体在溶液中的进一步的化学反应,如CO2的溶解:CO2(g)CO2(aq)CO2(aq)+H2OH+HCO3+(2)氧气在水中的溶解性氧在水中的溶解度与水的温度、氧在水中的分压及水中含盐量有关。在1.0130×105Pa、25℃饱和水中溶解度为8.32mg/L。水在25℃时的蒸气压为0.03167×105Pa。而空气中氧的含量为20.95%,氧的分压为:pO2=(1.10310–0.03167)×105×0.2095×105=0.2065×105代入亨利定律即可求出氧在水中的摩尔浓度为:[O2(aq)]=KH·pO2=1.26×10-8×0.02065×105=2.6×10-4氧的分子量为32,因此其溶解度为8.32mg/L氧气溶解度随着温度的变化,要求会计算。Lg(C2/C1)=H/(2.303R)(1/T△1-1/T2)(3)二氧化碳气体在水中的溶解性自学CO2的溶解...