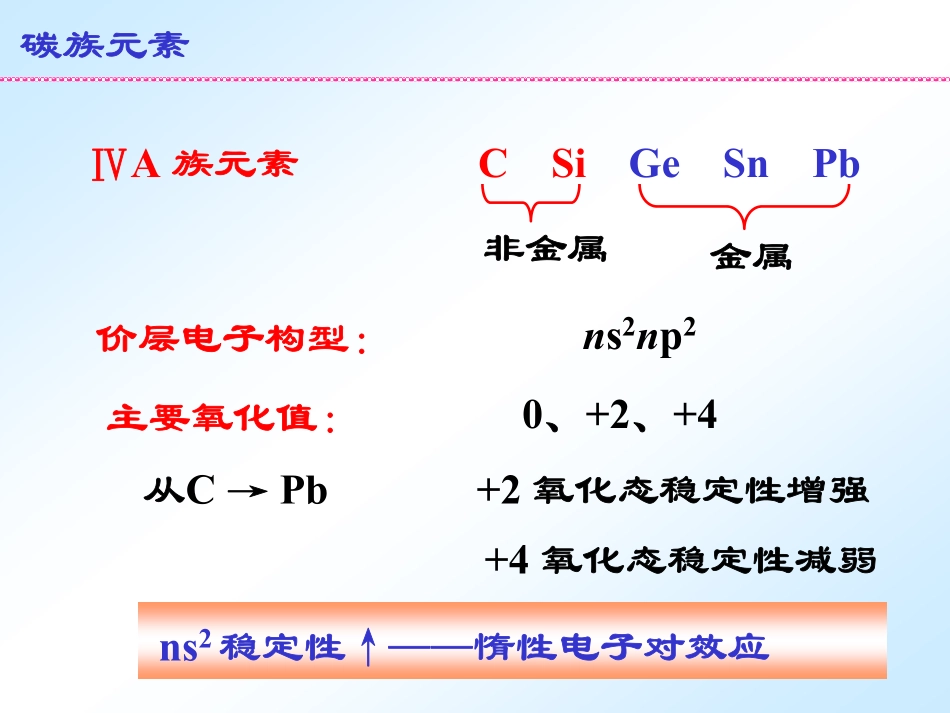
第14章碳族元素ⅣA族元素CSiGeSnPbns2稳定性↑──惰性电子对效应非金属金属价层电子构型:ns2np2主要氧化值:0、+2、+4从C→Pb+2氧化态稳定性增强+4氧化态稳定性减弱碳族元素有机化合物:动植物体,煤,石油,天然气碳元素是构成有机物骨架的元素。碳C单质:石墨,金刚石,C60,C70无机化合物:CO2,白云石MgCa(CO3)2,石灰石、大理石、方解石CaCO3碳族元素方解石(CaCO3)以Si-O-Si键存在,丰度排第2位,存在于水晶、石英、SiO2和其它硅酸盐矿物中,硅元素是构成无机物骨架的元素。硅Si碳族元素水晶(SiO2)锗Ge锗石矿Cu2S·FeS·GeS2锡Sn锡石矿SnO2,云南个旧称为锡都铅Pb方铅矿PbS14-1碳单质及其化合物第14章碳族元素14-2硅单质及其化合物14-3锗、锡、铅14-1-1碳元素的单质1碳的同素异形体2碳单质的还原性14-1-2碳的含氧化合物1一氧化碳2二氧化碳3碳酸和碳酸盐14-1碳单质及其化合物1碳的同素异形体原子晶体,是硬度最大、熔点最高的单质,化学性质很稳定。14-1-1碳元素的单质1碳的同素异形体(1)金刚石名贵的金刚石(钻石)立方晶系,碳原子发生sp3杂化,以sp3杂化轨道重叠成键,呈正四面体。14-1-1碳元素的单质1碳的同素异形体(1)金刚石金刚石的晶体结构所有价电子都参与共价健的形成,无离域电子,不导电。14-1-1碳元素的单质1碳的同素异形体(1)金刚石14-1-1碳元素的单质1碳的同素异形体硬度较小,熔点较高,表现出一定程度的化学活性。碳原子发生sp2杂化,sp2杂化轨道重叠成键,呈平面三角形,余下的p轨道形成大键(),形成片层状结构。nn石墨晶体结构示意图(2)石墨离域电子使得石墨沿层向具有良好导电性。可制作电极、热电偶、坩锅、铅笔芯等。石墨晶体结构示意动画14-1-1碳元素的单质1碳的同素异形体(2)石墨木炭和焦炭基本属于石墨类型,但是晶形不完整。层与层之间以分子间力结合,层间的分子间力很弱,所以层间易于滑动,故石墨质软具有润滑性。(3)碳原子簇C60分子(富勒烯)的结构14-1-1碳元素的单质1碳的同素异形体60个碳原子构成近似于球形的32面体,即由12个正五边形和20个正六边形组成,相当于截角正20面体。C60室温下为分子晶体,具有较高的化学活性。20世纪80年代中期,发现第三种晶体形态:Cn(n<200)1985年,C60的发现是人类对碳认识的新阶段,是科学上的重要发现。美国科学家Curl和Smalley教授及英国科学家Kroto教授为此获得1996年诺贝尔化学奖。14-1-1碳元素的单质1碳的同素异形体每个碳原子以sp2杂化轨道和相邻三个碳原子相连,未参加杂化的p轨道在C60的球面形成大键。(3)碳原子簇14-1-1碳元素的单质1碳的同素异形体2碳单质的还原性14-1-2碳的含氧化合物1一氧化碳2二氧化碳3碳酸和碳酸盐14-1碳单质及其化合物C+O2CO22C+O22CO14-1-1碳元素的单质2碳单质的还原性2碳单质的还原性2CO+O22CO2该反应可以看作是下列两反应差的2C+O22CO(b)2Zn+O22ZnO(d)21该反应为何在1200K温度下进行?产物为什么是CO,而不是CO2?ZnO+CZn(g)+CO(g)14-1-1碳元素的单质2碳单质的还原性可通过各反应的△rGmθ随温度T的变化来说明。焦炭是冶金工业上重要的还原剂,还原金属氧化物:根据ΔrGmθ=ΔrHmθ–TΔrSmθ,作ΔrGmθ随温度T的变化曲线,是斜率为-ΔrSmθ的直线。14-1-1碳元素的单质2碳单质的还原性C+O2CO2(a)ΔrSmθ=2.9J·K-1·mol-12C+O22CO(b)ΔrSmθ=178.8J·K-1·mol-12CO+O22CO2(c)ΔrSmθ=-173.0J·K-1·mol-12Zn+O22ZnO(d)ΔrSmθ=-201J·K-1·mol-1△rGmθ/kJ·mol-1在(d)(b)两线交点所对应的温度T1≈1200K下,(d)和(b)的相等,(1)的=0,当T>T1时,碳还原氧化锌的反应就可自发进行。ΔrGmθΔrGmθ14-1-1碳元素的单质2碳单质的还原性(d)(b)T1(a)(c)2C+O2=2CO2CO+O2=2CO2C+O2=CO22Zn+O2=2ZnOZnO+CZn(g)+CO(g)(1)[(b)-(d)]/2△rGmθ/kJ·mol-114-1-1碳元素的单质2碳单质的还原性(d)(b)T1(a)(c)2C+O2=2CO2CO+O2=2CO2C+O2=CO22Zn+O2=2ZnOT2当T>T2时,产物为CO2,而不是CO。金属氧化物的Ellingham(艾林汉姆)图判别某一金属从其化合物中还原出来的难易和还原剂的选择,可用艾林汉姆图。金属氧化物的艾林汉姆图omrGK/T2C+O22CO2...