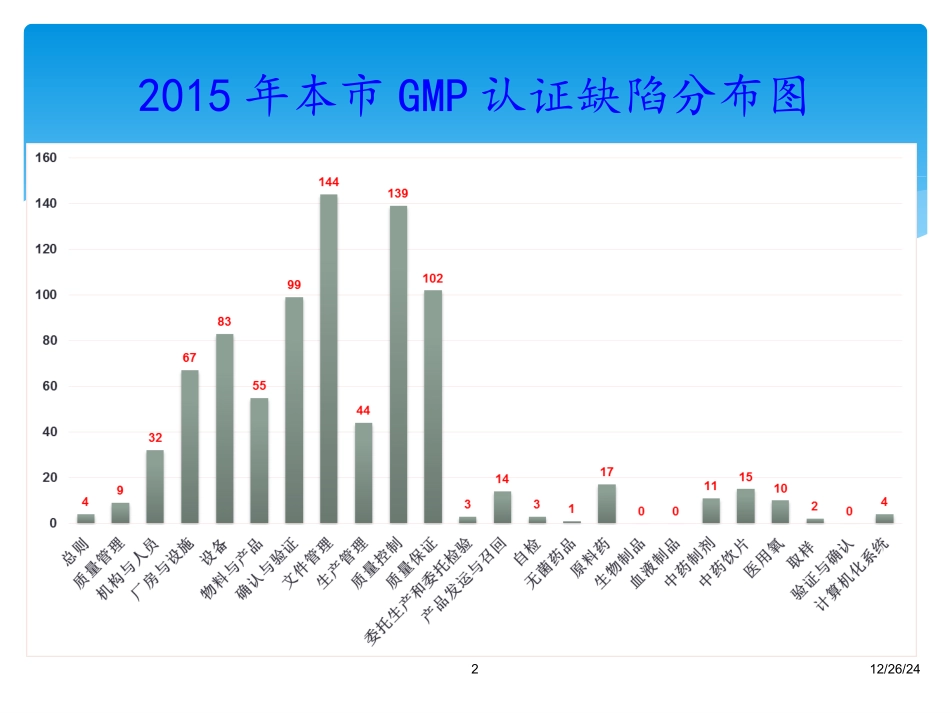
GMP检查常见问题剖析质量控制与质量保证12/26/2422015年本市GMP认证缺陷分布图质量控制与质量保证常见缺陷分析涉及2010版GMP第十章,该章共有61条。34案例某企业质量控制实验室未配备红外标准图谱,不保证原辅料鉴别的准确性。(主要)第二百二十条质量控制实验室应当配备药典、标准图谱等必要的工具书,以及标准品或对照品等相关的标准物质5案例直接接触药品的氮气未制定进厂检验操作规程;检验记录的修改不规范,例如个别容量瓶的校准记录无修改人员签名。例1对化验室仪器未制定维护、保养规程,无相关记录。例2第二百二十一条质量控制实验室的文件应当符合第八章的原则,并符合下列要求:(一)质量控制实验室应当至少有下列详细文件:(二)每批药品的检验记录应当包括中间产品、待包装产品和成品的质量检验记录,可追溯该批药品所有相关的质量检验情况;(三)宜采用便于趋势分析的方法保存某些数据(如检验数据、环境监测数据、制药用水的微生物监测数据);(四)除与批记录相关的资料信息外,还应当保存其他原始资料或记录,以方便查阅。GMP6案例取样时使用的取样工具数量偏少,不能防止物料取样过程中的交叉污染,未记录每一取样包装的取样量;《原辅料取样SOP》中未规定工艺用水取样至分样后的存放时间及存放条件,水样的取样人员与检验人员为同一操作者。例1取样人员未经授权,未规定原辅料分样数量。例2第二百二十二条取样应当至少符合以下要求:(一)质量管理部门的人员有权进入生产区和仓储区进行取样及调查;(二)应当按照经批准的操作规程取样,操作规程应当详细规定:(三)取样方法应当科学、合理,以保证样品的代表性;(四)留样应当能够代表被取样批次的产品或物料,也可抽取其他样品来监控生产过程中最重要的环节(如生产的开始或结束);(五)样品的容器应当贴有标签,注明样品名称、批号、取样日期、取自哪一包装容器、取样人等信息;(六)样品应当按照规定的贮存要求保存。GMP7案例a)氢氧化钠标准溶液标化记录中基准物恒重仅有一次称量数据,未能体现恒重过程;b)部分项目检验原始记录未记录试验现象;c)成品检验原始记录缺少贮备液编号及储备液稀释处理的记录。第二百二十三条物料和不同生产阶段产品的检验应当至少符合以下要求:(一)、(二)、(三)、(四)、(五)、(六)、(七)、(八)、(九)8案例某企业地巴唑原料药供应商上于2011年6月7日获得药品补充申请批件(批件号:2011B00985),增加了有关物质的检测项,对特定杂质、其他单个杂质和总杂质进行了控制,但该企业未及时修订地巴唑原料药的检验标准操作规程,也未进行该项目的检验方法学确认,更未进行地巴唑原料药有关物质的检测。(第223条)9案例地巴唑片14份检验记录(130101-150406)中原辅料如地巴唑(11131003)、糊精(20131029)、蔗糖(140101)等的检验记录缺仪器型号、温度、样品处理过程、滴定液名称、浓度、天平的使用、取样单等信息,不能对仪器天平取样信息等数据可靠性进行追溯(第223条)10案例OOS调查记录不能完全体现《OOS调查处理规程》(编号:***)的要求。某中间体OOS调查表(编号:***)未体现炽灼残渣、重金属检查两个不合格项目的调查情况。第二百二十四条质量控制实验室应当建立检验结果超标调查的操作规程。任何检验结果超标都必须按照操作规程进行完整的调查,并有相应的记录。11案例干粉培养基台账中未记录培养基批号;2011年5月13日从黑龙江省所购买的枯草芽孢杆菌无销毁记录。例1培养基与化学试剂存放在同一个库房内。由于空间有限,空气流动性不好,培养基易造成被污染;用于无菌检查的外购0.9%NaCl溶液未进行无菌确认。例2第二百二十六条试剂、试液、培养基和检定菌的管理应当至少符合以下要求:GMP12案例10-DAB供应商标识贮存条件为凉暗处,作为起始物料使用时企业规定贮存温度为-15℃,而该物料作为对照品使用时企业实际贮存温度为2-8℃。第二百二十七条标准品或对照品的管理应当至少符合以下要求13案例对某注射液所用辅料三氯叔丁醇因水分超过《中国药典》标准规定,进行风险评估放行后,即将该物料内控质量修订,使得“水分”项低于国家...