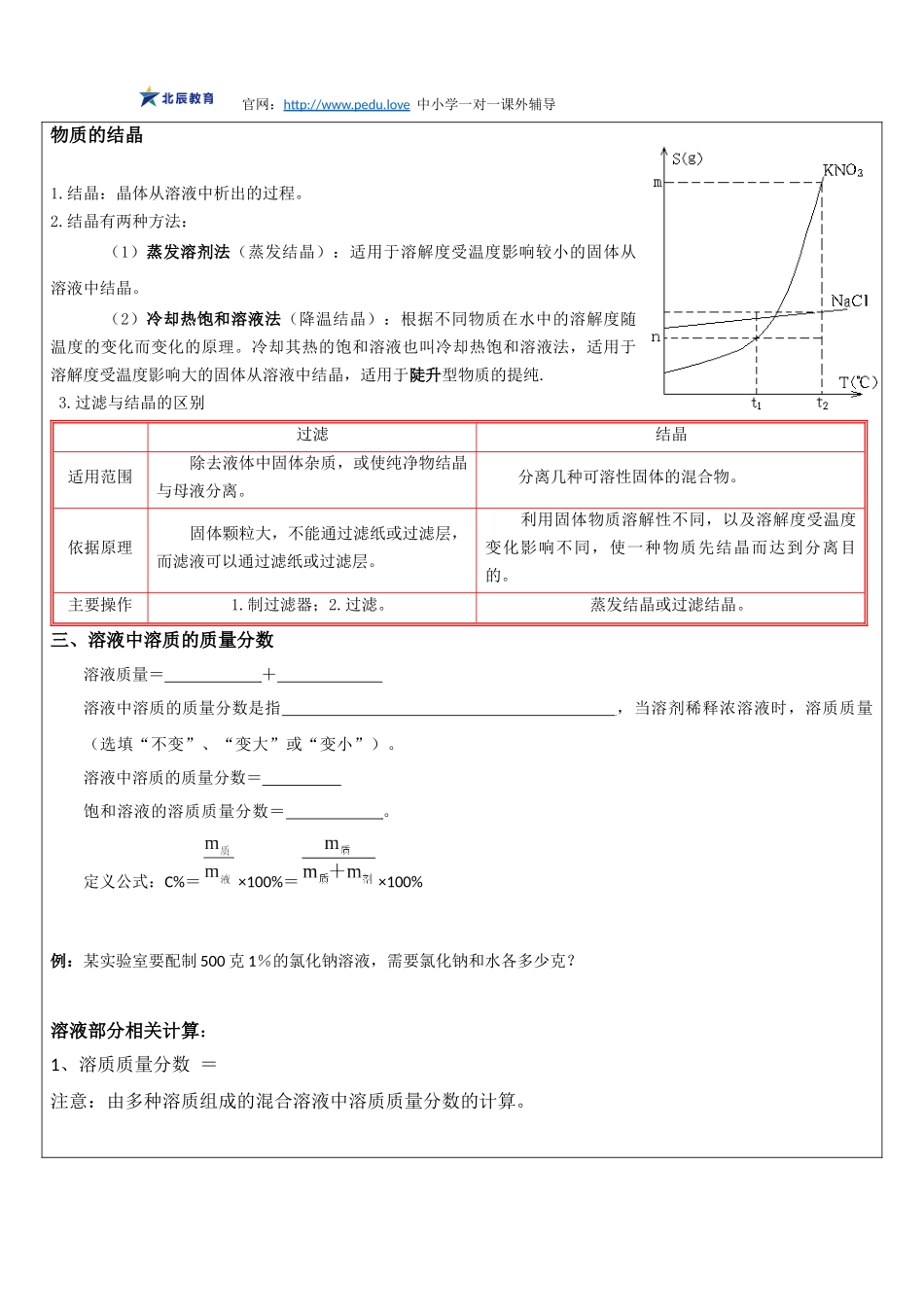
官网:http://www.pedu.love中小学一对一课外辅导物质的结晶1.结晶:晶体从溶液中析出的过程。2.结晶有两种方法:(1)蒸发溶剂法(蒸发结晶):适用于溶解度受温度影响较小的固体从溶液中结晶。(2)冷却热饱和溶液法(降温结晶):根据不同物质在水中的溶解度随温度的变化而变化的原理。冷却其热的饱和溶液也叫冷却热饱和溶液法,适用于溶解度受温度影响大的固体从溶液中结晶,适用于陡升型物质的提纯.3.过滤与结晶的区别过滤结晶适用范围除去液体中固体杂质,或使纯净物结晶与母液分离。分离几种可溶性固体的混合物。依据原理固体颗粒大,不能通过滤纸或过滤层,而滤液可以通过滤纸或过滤层。利用固体物质溶解性不同,以及溶解度受温度变化影响不同,使一种物质先结晶而达到分离目的。主要操作1.制过滤器;2.过滤。蒸发结晶或过滤结晶。三、溶液中溶质的质量分数溶液质量=+溶液中溶质的质量分数是指,当溶剂稀释浓溶液时,溶质质量(选填“不变”、“变大”或“变小”)。溶液中溶质的质量分数=饱和溶液的溶质质量分数=。定义公式:C%=×100%=×100%例:某实验室要配制500克1%的氯化钠溶液,需要氯化钠和水各多少克?溶液部分相关计算:1、溶质质量分数=注意:由多种溶质组成的混合溶液中溶质质量分数的计算。官网:http://www.pedu.love中小学一对一课外辅导2、溶液质量与体积之间的换算:溶液质量(克)=溶液体积(毫升)×溶液密度(克/毫升)3、溶液的稀释:m浓溶液×a%=m稀溶液×b%(a>b)其中:m稀溶液=m浓溶液+m水若用溶质质量分数不同(a%、b%)的溶液A、B,配制中间溶质质量分数的溶液(c%),则:mA×a%+mB×b%=(mA+mB)×c%7、溶解度、溶质质量分数计算公式,关系:饱和溶液中溶质质量分数=×100%8、饱和溶液与不饱和溶液的相互转化一般:(特例:熟石灰)①降温②加溶质③蒸发溶剂不饱和溶液饱和溶液①加溶剂②升温9、溶解度曲线图:记住常见三种物质的溶解度曲线10、混合物分离提纯方法:过滤、蒸发、结晶、洗涤11、结晶方法:①蒸发溶剂(如:NaCl)②冷却热饱和溶液(如:KNO3)也叫降温结晶,应用:提纯KNO3(NaCl杂质)二、注意点:1、溶液是均一、稳定的混合物;2、它不一定是无色,但一般透明;3、溶质可以是气体、液体、固体,没有溶解的物质是不能作为溶液的一部分,也不可看做溶质。4、饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液。5、饱和和不饱和溶液的意义在于指明“一定温度”和“一定量的溶剂”,6、气体物质溶解度还与压强有关。7、溶解度四点把握:温度、100克溶剂、达到饱和状态、溶解的溶质的质量8、蒸发溶剂有晶体析出,剩余溶液一定是饱和溶液9、溶质质量分数与温度无关,只与溶质和溶液质量有关10、利用溶解度曲线可查找某温度下某物质的溶解度,可利用根据曲线判断某物质溶解度受温度影响情况,也可以比较同温度下不同物质的溶解度的大小等。官网:http://www.pedu.love中小学一对一课外辅导【典型例题】1.关于溶解度的计算的类型(1)已知一定温度下,饱和溶液中溶质的质量和溶剂的质量。求该温度下的溶解度。例如:①把50克20℃时的硝酸钾饱和溶液蒸干,得到12克硝酸钾。求20℃时硝酸钾的溶解度。解析:溶液的质量为溶质质量和溶剂质量之和,因此50克硝酸钾饱和溶液中含水的质量是:50克-12克=38克设:20℃时100克水里溶解硝酸钾达到饱和状态时所溶解的质量为x溶质溶剂溶液12g38g50gx100g解得x=31.6g.答:20℃时硝酸钾的溶解度为31.6克(2)已知某温度时物质的溶解度,求此温度下饱和溶液中的溶质或溶剂的质量。例如:把100克20℃时硝酸钾的饱和溶液蒸干,得到24克硝酸钾。则:①若配制350克20℃的硝酸钾的饱和溶液,需硝酸钾和水各多少克?②若将78克硝酸钾配成20℃时的饱和溶液,需水多少克?解析:设配制350克20℃的硝酸钾的饱和溶液,需硝酸钾和水的质量分别为x和y。将78克硝酸钾配成20℃时的饱和溶液,需水质量为z溶质溶剂溶液24g100gxy350g78gz解得x=84g,y=266g。解得再z=247g。总之,关于溶解度计算的关键就是将一定温度下溶液中溶质、溶剂、溶液的质量关系一一对应,列出正确的比例式求算。[例...